- Microbiología
- Bacterias
- Eucariotas
- Virus
- Herramientas
- Blog
Tras analizar diversos métodos de control del crecimiento microbiano ahora veremos a los agentes quimioterápicos. Son agentes antimicrobianos de aplicación in vivo. De estos, los más conocidos son los antibióticos, aunque otros más.
Tienen toxicidad selectiva: inhiben el crecimiento o eliminan a los microorganismos de forma selectiva, sin afectar al tejido humano. Se excluyen aquellos usados en la terapia de enfermedades no causadas por microorganismos. Deben actuar dentro del hospedador, por lo que no deben de alterar los mecanismos naturales de sus células. El grado de toxicidad selectiva se puede indicar por el nivel terapéutico: cociente entre dosis tóxica (nivel de fármaco al que el agente se vuelve excesivamente tóxico para el hospedador) y la dosis terapéutica (nivel de fármaco necesario para el tratamiento clínico de una infección determinada). A mayor nivel terapéutico, mejor es el fármaco. Así el nivel terapéutico = dosis tóxica/ dosis terapéutica.
Los agentes quimioterápicos se clasifican en: naturales (sintetizados por los microorganismos) y sintéticos (sintetizados en el laboratorio por procedimiento químicos).
Índice de contenidos
Se incluyen análogos estructurales de factores de crecimiento, que son sustancias químicas específicas requeridas en el medio de cultivo porque los microorganismos no los pueden sintetizar. Son potentes inhibidores: ocupan el lugar del factor de crecimiento pero no funcionan como tal. Algunos tienen toxicidad selectiva, por lo que pueden tomarse internamente. En general, muestran propiedades microbioestáticas. Los que no tienen toxicidad selectiva se usan como mutágenos. Pueden ser análogos a:
Son análogos estructurales del PABA. Tienen una estructura común a todas, se diferencian unas de otras por unas cadenas laterales (R1 y R2) que varían de unas a otras. El PABA es un precursor a su vez del acido tetrahidrófolico (THF); una de las tres partes del PABA procede del THF. El THF es un coenzima esencial para la síntesis de bases nitrogenadas y algunos aminoácidos; por lo tanto, es esencial para las reacciones biosintéticas como síntesis de ácidos nucleicos, proteínas, etc.
Son bacteriostáticas. Se han sintetizado más de 1000 diferentes. In vitro son de alto espectro (efectivas contra gran numero de bacterias) pero in vivo tienen un espectro más reducido (solo frente algunos microorganismos del genero Streptococcus, pero no contra todos, como Streptococcus faecalis que toma el acido fólico del paciente). Son muy frecuentes los casos de alergias y resistencia. Se administran por vía oral y tópica, no por vía parenteral (intravenosa).
Tienen algunas aplicaciones especiales: se usa como método preventivo en el caso de contacto directo con pacientes afectados por meningitis meningocócica (Neisseria meningitidis), en pacientes con quemaduras (la sulfadiazina de plata), en casos de infecciones del tracto urinario (uretritis causadas por clamidias), en infecciones oculares (como preparaciones oftálmicas: la sulfacetamida), etc.
Como las sustancias derivadas del furfural: los nitrofuranos (tienen un grupo nitro y una estructura furfural). Además, aparecen las oxazolidinonas y las quinolonas.
Los antibióticos son sustancias antimicrobianas de naturaleza no proteica y bajo peso molecular, que en pequeñas cantidades inhiben el crecimiento o destruyen los microorganismos y están producidas como metabolitos secundarios por unos pocos tipos de microorganismos del suelo.
Según su naturaleza, se clasifican en:
La clasificación que vamos a usar es en función de su diana de acción, ya que afectan a determinados lugares de la célula:
La fosfomicina o fosfonomicina. Producida por Streptomyces fradiae. Bloquea la síntesis del peptidoglicano: es un análogo estructural del PEP (ácido fosfoenolpirúvico, inhibidor de una ruta específica de procariotas). Se usa solo en algunos casos de tratamiento de infecciones urinarias, aunque se usa poco porque hay muchos casos de resistencia.
La D-cicloserina, producida por Streptomyces orchidaceus. Es un análogo estructural de la D-alanina: inhibe tanto la reacción de la racemasa como la de la ligasa. Transforma el peptidoglicano en una malla laxa que provoca la lisis osmótica. Tiene un bajo nivel terapéutico, es muy toxico para el SNC. Solo se usa en algunos casos de tuberculosis en individuos que no responden al tratamiento convencional.
La bacitracina producida por Bacillus licheniformis y por Bacillus subtilis. Antibiótico con un anillo tiazol. Bloquea la desfosforilación del bactoprenol, por lo que bloquea la síntesis del peptidoglicano. Es nefrotóxico. Tiene un uso tópico para el tratamiento de quemaduras y laceraciones.
La vancomicina, producida por Streptomyces orientalis, y la ristocetina, producida por Nocardia lurida. Ambas son glicopéptidos con estructura muy compleja. Actúan formando un complejo con el extremo acil-D-alanil-D-alanina: bloquean el entrecruzamiento de los tetrapeptidos del peptidoglicano. Ambas son tóxicas, con un espectro bastante reducido. Actúan sobre GRAM+.
La lisozima también rompe el peptidoglicano. Es una enzima, no un antibiótico. Rompe las enlaces glicosídicos del peptidoglicano: quedan el NAG y el NAM. El resultado es la entrada de agua a la célula y la lisis osmótica. Se encuentra en lágrimas, saliva, fluidos corporales, en el interior de los neutrófilos, etc. Constituyen una de las primeras líneas de defensa natural.
Los β-lactámicos. Son los principales. Nos vamos a centrar en penicilinas y cefalosporinas. Todos tienen un uso clínico. Ambas conjuntamente constituyen la mitad de los antibióticos producidos del mundo.
Primero se clasifican en función de la subunidad con la que interactuan. Dentro de este orden, se subclasifican en función de la reacción que provocan dentro de la síntesis de proteínas.
Son antibióticos de muy amplio espectro: no solo actúan contra GRAM+ y GRAM-, sino también incluso contra bacterias parásitas intracelulares. Tienen un carácter hidrofóbico, lo que facilita su difusión a través de las membranas. Están producidas por diferentes especies del genero Streptomyces. Son bacteriostáticos. Su estructura consta de 4 anillos quinónicos unidos a diversas cadenas laterales. Se pueden administrar por vía oral, parenteral y tópica.
Tienen efectos adversos: las tetraciclinas naturales se absorben mal por el intestino y pueden destruir la microbiota autóctona, favoreciendo las infecciones secundarias causadas por microorganismos presentes previamente en nuestro intestino, que hasta ese momento estaban controlados por la microbiota autóctona. Las semisintéticas evitan este problema. Ambas se depositan en los tejidos calcificados, dañando huesos y dientes. Mecanismo de acción: bloquean el sitio A del ribosoma evitando la unión del aminoacil-tRNA al sitio A.
Son bactericidas de amplio espectro. Son un grupo amplio y variado de antibióticos producidos por algunas especies del genero Streptomyces. Interaccionan con la 30S.
Respecto a su estructura: son muy policatiónicos y muy polares. Constituidos por la combinación de dos tipos de compuestos: un azúcar y alcohol cíclico que pueden estar o no aminados. La mayoría están compuestos por un aminoglucósido y un aminociclitol. Se administran por vía parenteral, ya que por vía oral se absorben mal. Además penetran poco en el líquido cefalorraquídeo. Se excretan muy rápidamente a través de la orina. Pueden provocar parálisis neuromuscular, presentan ototoxicidad (puede provocar sordera). Presentan nefrotoxicidad. Su uso debe limitarse a infecciones ocasionadas por bacterias resistentes a otros antibióticos. Mecanismo de acción: tienen efectos pleiotrópicos (múltiples efectos) y efectos que se influyen entre sí. Mecanismo paso a paso de la estreptomicina:
Interaccionan con la 50S. Son un grupo variado y heterogéneo de antibióticos que intervienen con el centro peptidil-transferasa de la 50S. El cloranfenicol se obtiene a partir de Streptomyces venezuelae, aunque ahora resulta más económica su síntesis química. Es un bacteriostático de amplio espectro. Se absorbe muy bien por vía oral y penetra bien en todos los tejidos, por eso se puede usar frente a meningitis, para fiebres tifoideas, y contra anaerobios GRAM-. Hay que controlar bien la dosis porque puede provocar aplasia medular (destrucción de las células de la medula); de hecho casi no se emplea en países occidentales, aunque en el tercer mundo si que se usa.
Mecanismo de acción: se une en varios lugares de la 50S, de los cuales el más importante es la proteína L16, que forma parte de la peptidil-transferasa. Al unirse ahí inhibe la actividad de la peptidil-transferasa y se bloquea su actividad (la formación de los enlaces peptídicos). Ha sido muy útil para el estudio de los ribosomas.
Son lincosaminas, como la lincomicina (natural) y la clindamicina (derivado clorado de la lincomicina). El semisintético es más eficaz (en general siempre es así).
Se usan para tratar infecciones en la que no se pueden aplicar los β-lactámicos. También se emplean contra anaerobios, como por ejemplo en infecciones por el género Bacteroides. Mecanismo de acción: se unen a la porción 23S de la subunidad 50S y bloquean la formación del enlace peptídico. Interfieren en la colocación adecuada del aminoacil-tRNA en el sitio A y el peptidil-tRNA en el sitio P.
Es el representante más típico de la síntesis de la traslocación. Es un macrólido bacteriostático. Se usa en lugar de la penicilina en pacientes alérgicos a los β-lactámicos, y fundamentalmente en inflamaciones de las vías respiratorias (difteria, tosferina, neumonías…) e infecciones de la piel.
Mecanismo de acción: se une a la proteína L15 del centro peptidil-transferasa y bloquea la traslocación, interfiriendo específicamente en el avance del mRNA.
Es un derivado esteroideo producido por un hongo del género Fusarium. Se usa contra estafilococos resistentes a β- lactámicos de bacterias GRAM+. Se emplea tópicamente y de forma oral. Es bacteriostático.
Mecanismo de acción: se une al factor de elongación G (EFG) e inhibe la liberación del complejo EFG-GTP.
Pueden alterar su estructura y afectar a su función. En este grupo están los antibióticos menos selectivos. Son altamente tóxicos porque todos los organismos tienen membranas similares entre ellos. Esto les resta bastante interés clínico.
Las polimixinas son una familia de polipéptidos producidos por Bacillus polymyxa. Se designan con letras desde la A hasta la E, aunque solo la B y la E están disponibles para uso clínico.
Mecanismo de acción: son bactericidas que se comportan como detergentes catiónicos. Tienen un extremo hidrofílico y otro hidrofóbico: este último es que se une a los fosfolípidos de la membrana plasmática, desorganizando su estructura y aumentando la permeabilidad. Su uso se restringe a bacterias GRAM-. La resistencia de las bacterias está relacionada con la impermeabilidad de la membrana plasmática para este tipo de fármacos, como es el caso de las GRAM+.
Inconvenientes: neurotoxicidad y nefrotoxicidad. Tiene un uso muy limitado, como por ejemplo a infecciones graves causadas por bacterias GRAM-. Se administran por diversas vías, menos por vía parenteral.
Los polienos, como la nistatina, producida por Streptomyces noursei, o la anfotericina B, producida por Streptomyces nodosus. Tienen dobles enlaces. Además tienen una hexosamina. Se unen al ergosterol, por lo que son activos frente a hongos (en hongos el ergosterol sustituye al colesterol de la membrana). La anfotericina es anfótera: tiene un grupo ácido y un grupo amino. Eso le permite ser relativamente soluble en agua. En general, los polienos tienen una parte de la molécula tienen numerosos dobles enlaces (hidrofóbica) y otra parte con numerosos grupos OH (hidrofílica).
Mecanismo de acción: la parte hidrofóbica se une al ergosterol e introduce la parte hidrofílica. Así se altera la estructura de la membrana y se forman unos poros que modifican su permeabilidad. A través de esos poros se pierde potasio y otros contenidos celulares. Producen la lisis de las células fúngicas. Además, también actúan en fase de reposo o estacionaria.
Uso y reacciones adversas: tienen un elevado potencial tanto nefrotóxico como hepatotóxico, especialmente la anfotericina B. Aunque con menor afinidad, también se pueden unirse a los lípidos de las membranas de los mamíferos: por eso su uso está restringido a infecciones fúngicas severas y sistémicas.
Los ionóforos y los formadores de canales. Los ionóforos, como la valinomicina, producida por Streptomyces fulvissimus. Son antibióticos polipeptídicos cíclicos. La valinomicina tiene una estructura circular hidrofóbica por fuera e hidrofílica en el interior. Los ionóforos incorporan cationes monovalentes como potasio, lo que les permite cruzar la membrana. Si se trata de potasio, la entrada de una elevada concentración de potasio va a alterar el gradiente químico de la membrana, alterando su función. Los formadores de canales, como la gramicidina, producida por Bacillus brevis. Son polipéptidos acíclicos con un mecanismo de acción diferente al de los ionóforos. Las cadenas de aminoácidos lineales se enroscan unas con otras y forman canales que se van a introducir en la membrana, formando un paso selectivo de moléculas.
La gramicidina es efectiva frente a GRAM+. Se usa en preparaciones oftálmicas contra conjuntivitis, por ejemplo. Tiene una alta toxicidad: se usa en preparaciones tópicas u oftálmicas.
Las actinomicinas, producidas por el género Streptomyces. Fue el primer antibiótico descubierto por Woksman, aunque en realidad son un conjunto de antibióticos. Mecanismo de acción: se unen al DNA en el complejo de iniciación y evitan que se produzca la transcripción. Puede unirse a la doble cadena de DNA por lo que puede interferir en la replicación de DNA, aunque no se usa con ese fin en concreto. No tienen uso clínico. La actinomicina D es una de las primeras drogas que se usó durante muchos años en tratamientos de quimioterapia: fue el primer antibiótico que mostro tener cierta actividad anticancerígena. Es muy tóxico y provoca daños en el material genético.
Hoy en día se usa en investigación. A veces se usan sus derivados fluorescentes en microscopía y citometría de flujo. Tiene gran afinidad por las regiones ricas en G-C, lo que las convierte en excelentes marcadores de DNA.
Las rifamicinas, como la rifampicina, producida por Streptomyces mediterranei. Son antibióticos del grupo de las ansamicinas. Son usados para el tratamiento por infecciones de GRAM+ y algunas GRAM-. La rifampicina es muy importante por su poder tuberculostático: afecta a Mycobacterium tuberculosis. Penetra fácilmente en los fagocitos y puede destruir a las mycobacterias y a otros patógenos intracelulares. Otras aplicaciones son bastante limitadas porque su uso indiscriminado puede favorecer la selección de resistentes y hacer que el fármaco deje de tener utilidad. Mecanismo de acción: se unen a la subunidad β de la RNApolimerasa. Como nuestras RNA-polimerasas no son iguales a las de bacterias, se pueden usar con mayor frecuencia.
Siempre se utilizan combinados debido a la rapidez con la que se desarrollan resistencias. Se pueden administrar con sulfamidas, con isoniacida, etc.
Las mitomicinas, como al mitomicina C, producida por Streptomyces caespitosus. Hay varias: A,B y C. Tienen propiedades citotóxicas y antibacterianas. Poseen una estructura compleja.
La mitomicina C no se usa como antimicrobiano por su elevada toxicidad: se usa como antitumoral. Debe ser metabolizado, y el producto de su metabolización actúa como agente alquilante, que se une covalentemente al DNA formando puentes inter e intracatenarios. Especialmente se une a la guanina, en concreto al oxigeno en posición 6 de la guanina, lo que provoca una serie de interferencias importantes en los procesos en los que intervienen en DNA.
La novobiocina, producida por Streptomyces niveus. Es bacteriostático. Se une a la DNA-girasa y también bloquea la actividad ATPasa. Es un antibiótico activo por vía oral. Sobre todo es activo frente a GRAM+. Tienen un uso menor. Se usan muy poco por la alta incidencia de reacciones adversas. Además causa cepas resistentes, por lo que se suele administrar asociados con otro agente con el cual no tenga efecto antagónico (sino un efecto sinérgico).
La griseofulvina, producida por Penicillium griseofulvum. Es antifúngico. Se usa tanto en humanos como en animales para el tratamiento de micosis de la piel, cabello y uñas. Se puede administrar por vía oral. Mecanismo de acción: bloquea la tubulina, es decir, interviene en la acción de los microtúbulos polimerizados e inhibe la división de los hongos. Tiene afinidad por la piel: se deposita en las células basales que después se queratinizarán. Al queratinizarse retienen cantidad suficiente de esta droga para inhibir el crecimiento de los hongos dermatofitos. Forma un complejo con la queratina.
Para un tratamiento con cualquier agente hay que determinar su eficacia antimicrobiana frente a patógenos específicos. Esto se realiza mediante una serie de pruebas que pueden mostrar que agentes son más eficaces contra un determinado patógeno, y dar una estimación de la cantidad terapéutica que hay que proporcionar.
Son útiles para medir semicuantitativamente la actividad in vitro de un agente antimicrobiano frente a un determinado patógeno. Se emplean para medir o para determinar que midan lo que llama la CMI (concentración mínima inhibitoria) y CMB (concentración mínima bactericida). Se hace una dilución en tubo del agente que se va a probar, preparando una serie de tubos con caldo de cultivo, que habitualmente es el medio Mueller-Hinton, con distintas concentraciones del agente.
Habitualmente se emplea una concentración de entre 0,1-128 µm/ml. Se prepara una disolución madre de ese agente, cogemos un volumen de ese medio, diluyéndolo a la mitad, y seguimos hasta 0,1-0,25. Se inocula en cada tubo la misma cantidad de microorganismos, dejando un tubo control que no tenga el agente pero que si tenga el microorganismo. Incubamos a temperatura óptima del microorganismo entre 16 y 24h y observamos si hay crecimiento o no (turbidez) con un espectrofotómetro.
La CMI es la concentración mínima de agente a la que no se produce crecimiento tras el período de incubación. La CMB sería la concentración en la cual, las bacterias no crecen al trasladarlas al medio fresco. Para calcularla se cogen muestras de los tubos donde no ha habido crecimiento (por ejemplo, transfiriendo a una placa en ausencia de ese agente). Aquel agente que tenga la CMI más baja es el más adecuado.
En placas de Petri con agar se inocularían diferentes concentraciones del agente y se observa si hay o no crecimiento (no es lo común). El CMI y CMB por un lado, no dicen el efecto primario del agente: si el CMB>>CMI es un agente bacteriostático, pero si el CMB = CMI se trata de un agente bactericida. Para un microorganismo concreto los agentes que tengan la CMI mas baja serán los que tengan mayor actividad antimicrobiana frente a ese patógeno.
Estas pruebas son muy utiles para determinar el tratamiento mas adecuado ante un microorganismo cuya sensibilidad es desconocida e impredecible, o ante el fracaso de una terapia que parecía apropiada. La CMI realmente indica que concentración del agente se necesita en el sitio de acción donde actúa el patógeno para inhibir o destruir a ese microorganismo que está causando esa infección. Estas técnicas son semicuantitativas: el valor CMI es experimental, no representa un valor absoluto, y muchas veces el valor verdadero de la CMI se encuentra entre la menor concentración del agente que inhibe el desarrollo y la dilución siguiente que presenta desarrollo. Esto se debe a que en el experimento no usamos todos los valores de concentración del agente posible, usamos unos valores determinados.
Se puede realizar de dos maneras, pero siempre partimos de una placa con el microorganismo crecido al que le vamos a hacer las pruebas. En la primera forma, cogemos varias asas e inoculamos un tubo con caldo de cultivo. Tras unas pocas horas, se observa turbidez: obtenemos una suspensión bacteriana estandarizada. Con una torunda (bastoncillo de algodón largo) se coge una muestra y se extiende por toda la superficie de la muestra, y crece un césped.
Otra manera es con la técnica de doble capa de agar. Se hacen placas con dos capas de agar: la segunda capa contiene los microorganismos, y lo vertemos sobre la primera de manera que obtenemos el mismo efecto: se observa un crecimiento uniforme y homogéneo por toda la placa (césped). Eso si lo dejáramos incubar, aun no ha incubado. A continuación colocamos en la superficie discos de antibióticos o del agente antimicrobiano que corresponda. Se pueden colocar con unas pinzas esterilizadas, o con un dispensador de discos. Ahora se deja incubar. Se observara la presencia de unas zonas claras alrededor de los discos: los halos de inhibición.
Si no hay halo, el microorganismo es resistente al agente. Si se ve halo, se mide en mm el diámetro del halo. Alrededor del disco, el agente antimicrobiano va difundiendo radialmente a través del agar produciendo un gradiente de concentración (la mayor cerca del disco, la menor más alejada). Si probamos una misma concentración de un mismo agente frente a varios microorganismos, el diámetro de halo mayor indicara que ese patógeno concreto es muy resistente. Aunque no se puede deducir el grado de efectividad solo mirando el halo ya que su diámetro depende de otros factores también. Si se miden los diámetros de halo y se compara con datos estándar se puede establecer si un determinado organismo es verdaderamente sensible o resistente a un determinado agente.
Es un método experimental. Para cada agente se prepara una gráfica de escala logarítmica. Atendiendo a la concentración que se alcanza en el cuerpo se puede determinar si en la práctica el uso de ese agente es efectivo. De hecho, también hay que tener en cuenta que el comportamiento del patógeno puede variar en el laboratorio. Por ejemplo, Klebsiella es sensible a ampicilina in vitro pero resistente in vivo; no sería un antibiótico recomendable para el tratamiento de Klebsiella. Así que, conociendo estos datos para nuestro patógeno objetivo, debemos modificar los resultados.
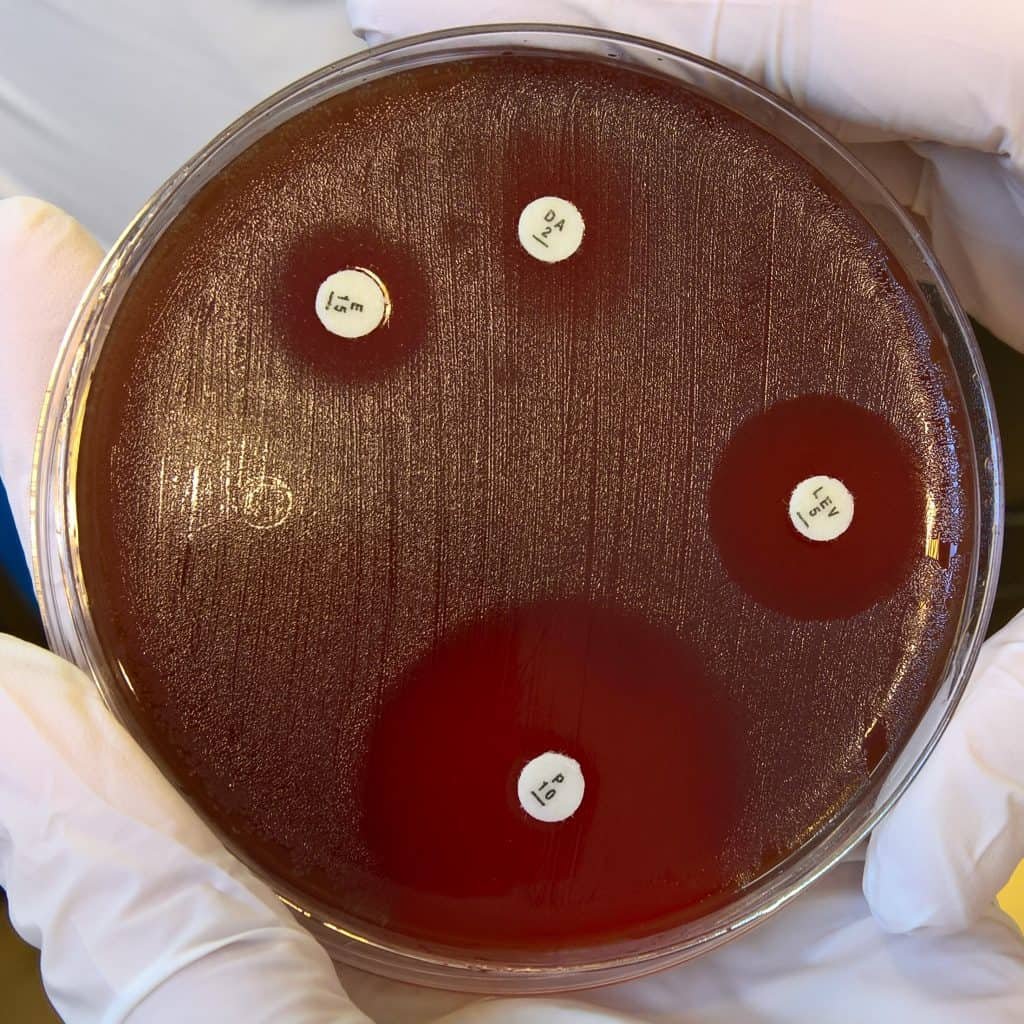
Si la CMI es muy alta, el diámetro será muy pequeño. Si es superior a concentraciones normales, el microorganismo es resistente para ese agente. Pero si es baja, el diámetro será grande. Si la concentración es inferior a las concentraciones normales en el cuerpo, el microorganismo será sensible para ese agente.
Definimos la resistencia como la capacidad de un organismo para soportar los efectos de un agente quimioterápico. Hay algunos patógenos que han desarrollado resistencias a prácticamente todos los agentes quimioterápicos conocidos, como algunas cepas de Stafilococcus aureus MRSA (Stafilococcus aureus resistente a meticilina). La meticilina es una penicilina resistente a β-lactamasas.
Mecanismos de adquisición de resistencias. La mayor parte de las resistencias son debidos a intercambios genéticos. Estos genes provienen sobre todo de la necesidad de protección que precisan los organismos productores de estos antibióticos. Una misma bacteria puede desarrollar varios mecanismos de resistencia frente a un mismo o a varios antibióticos. De un mismo modo que un mismo antibiótico puede ser desactivado por diversos mecanismos de varias especies bacterianas.
Además, los mutantes resistentes surgen de forma espontánea. Luego, esas mutaciones se hacen predominantes por la presión selectiva de los antibióticos que hacen que vayan desapareciendo paulatinamente las bacterias sensibles. Así van predominando los resistentes. Aquí no solo están implicados los antibióticos utilizados en medicina, sino los empleados en veterinaria que se usan en los piensos para poder acelerar el proceso de comercialización de los animales. Para destruir o inhibir a los microorganismos, los antimicrobianos deben atravesar al patógeno y luego deben fijarse a su diana de acción.
Resistencia natural o innata. Es la resistencia con la que el patógeno "nace", la que tiene de serie.
Resistencia adquirida. Es la más importante desde el punto de vista químico. Es debida a la modificación de la carga genética de la bacteria. Puede ser debida a:
Como un mismo plásmido puede portar genes de resistencia a varios fármacos, una población de bacterias patógenas se puede volver resistente a varios fármacos a la vez, formando así cepas multirresistentes. Incluso cuando el paciente ha sido mal tratado con un agente puede desarrollar cepas multirresistentes, aunque se le haya tratado con un solo agente de los que ha desarrollado resistencia. El resultado va a ser una alteración de la microbiota endógena y como consecuencia se pueden desarrollar patógenos multirresistentes. Se llega a una sobreinfección.
Ejemplo: el desarrollo de Clostridium difficile en individuos sanos constituye una parte pequeña de la microbiota intestina. Puede provocar una colitis pseudomembranosa cuando el paciente recibe un tratamiento que destruye muchas bacterias intestinales pero no la destruye a ella. Al no haber competidores prolifera y produce una toxina que estimula la excreción de una pseudomembrana por parte de las células intestinales. Puede llegar a causar la muerte del paciente. Son bastante frecuentes la sobreinfecciones por hongos, sobre todo por Candida albicans.
De hecho, las formas resistentes a los antibióticos ya se han convertido en un grave problema de salud pública del que hay que tomar conciencia. Para evitar las resistencias, y empeorar esta situación, se deben tener en cuenta una serie de recomendaciones: