- Microbiología
- Bacterias
- Eucariotas
- Virus
- Blog
Son los virus que infectan a los animales, de cualquier clase (mamíferos, aves, etc). A diferencia de los virus vegetales que entran a través de daños estructurales en la planta, estos virus necesitan de receptores celulares del huésped para entrar al hospedador. Normalmente solo necesitan un receptor para entrar a la célula, pero hay otros que necesitan también de un co-receptor o receptor secundario, como en el caso del VIH.
Las moléculas del virus implicadas en el reconocimiento celular se llaman anti-receptores. Pueden estar en la cápside del virus, en el caso de los virus desnudos, o en la envoltura del virus, en el caso de los virus envueltos. Pueden ser proteínas, generalmente en forma de glicoproteínas, o carbohidratos presentes en glicoproteínas o glicolípidos. No es común, pero virus sin relación entre si puede usar el mismo receptor celular. Por ejemplo, un azúcar, el ácido siálico, es receptor de Orthomyxovirus, y algunos Coronavirus y Reovirus.
Índice de contenidos
La fase de adsorción es el inicio de la replicación del virus. El virión contacta con la célula hospedadora para acceder a su interior, usando receptores celulares que pueden ser proteínas (normalmente en forma de glicoproteínas) o carbohidratos (presentes en glicoproteínas o glicolípidos). Aparecen dos modelos de adsorción.
El modelo está basado en la familia Picornaviridae. El receptor celular es la proteína ICAM-I (Intracellular Adhesion Molecule-I) presente en células del epitelio nasofaríngeo. ICAM-I posiciona el virus a una distancia cercana a la membrana y desencadena un cambio conformacional en el virus que acabará resultando en la entrada del material genético al citoplasma. En los virus icosaétricos regulares desnudos hay 3 tipos de protómeros que interaccionan entre si formando los triángulos, y, en el centro se queda un hueco (cañon). Pues bien, ICAM-I interacciona directamente con los residuos de aminoácidos localizados en el cañon de cada cara triangular.
El modelo está basado en Influenzavirus, el virus de la gripe. El receptor celular es el ácido siálico (ácido N-acetil-neuramínico), abundante en glicoproteínas y glicolípidos de diversos tipos celulares, lo que hace que estos virus tengan un rango de infección muy amplio. El antirreceptor viral es la hemaglutinina (HA), que forma espículas, o trímeros, en la superficie de la envoltura viral. Esta proteína reconoce al ácido siálico y se une a el, lo que provoca que el virus sea endocitado y entre a la célula.
Tras la fase de adsorción aparece la fase de penetración, en la que el virus usa diversos procesos celulares para su acometimiento.
Los virus desnudos entran por el proceso de endocitosis mediada por receptor. Hay dos modelos:
Los virus envueltos entran por fusión de membranas, proceso dirigido por una proteína viral, una proteína de fusión. Aparecen dos modelos:
Hay muchos virus animales, e iremos hablando de los más destacados. Se puede acceder a los distintos virus animales por aquí, o mediante su clasificación, sea mediante el Sistema Baltimore o de ICTV.
Su morfología es icosaédrica regular, y tienen un tamaño que varía entre 60 y 90 nm. Su genoma es lineal y tiene un tamaño de entre 30 y 38 kb. Pueden causar infecciones respiratorias, incluso neumonía, además de conjuntivitis y enfermedades gastrointestinales. Provocan aumento de antígenos T.
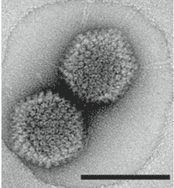
Su morfología es icosaédrica regular, y tienen un tamaño de 55 nm. Su genoma es circular y tiene un tamaño de 8 kb. Destaca el Papillomavirus humano (HPV) del cual se conocen hasta 90 serotipos distintos. Provoca tumores benignos, como papilomas o verrugas. HPV-16 y HPV-18 son responsables de más del 70% de casos de tumor de cuello uterino. Provocan aumento de antígenos T.
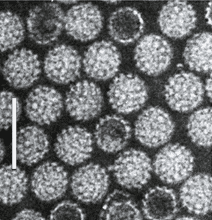
Su morfología es icosaédrica regular, y tienen un tamaño de 45 nm. Su genoma es circular y tiene un tamaño de 5 kb. Destaca el género Polyomavirus; sus especies son capaces de inducir transformaciones celulares in vivo e in vitro: formación de tumores. Provocan aumento de antígenos T.
Especies a destacar: SV-40 en simios, Polyomavirus BK, asociado a trasplantes renales, y Polyomavirus JC, que puede provocar leucoencefalopatía multifocal.
Su morfología es icosaédrica regular, y tienen un tamaño de entre 10 y 26 nm. Su genoma es lineal y tiene un tamaño de 5 kb. Destacan el género Parvovirus, patógenos de perros, gatos, cerdos y roedores, y el género Erythrovirus, patógeno humano.
Del género Erythrovirus destaca el virus B19, causante de reticulosis en fetos y recién nacidos.
Su morfología es icosaédrica regular, cuenta con una cápside doble, y tienen un tamaño que varía entre 70 y 85 nm. Su genoma está dividido entre 10 y 12 segmentos. Infectan a vertebrados e invertebrados; también a plantas.
Destacan el género Orbivirus, causante de la peste equina africana, y el género Rotavirus, asociado a diarrea infantil en países en desarrollo.
Su morfología es icosaédrica regular, y tienen un tamaño de 25 nm. Su genoma tiene un tamaño de entre 7.2 y 8.5 kb.
Destacan el género Enterovirus, que tiene el virus de la poliomielitis, el género Rhinovirus, causante del rhinovirus humano tipo A, y el género Hepatovirus, causante de la hepatitis A. Los picornavirus pueden causar cuadros clínicos leves, como el resfriado común, o graves, como la polio.
Su morfología es icosaédrica regular, y tienen un tamaño de entre 80 y 120 nm. Su genoma es lineal y tiene un tamaño de entre 130 y 230 kb.
De la subfamilia α-Herpesviridae destacan el género Simplexvirus, del cual HSV-1 provoca herpes labial y HSV-2 causa herpes genital, y el género Varicellovirus, del cual VZV causa varicela-zoster.
De la subfamilia β-Herpesviridae destacan el género Cytomegalovirus, del cual HCMV provoca el citomegalovirus humano.
De la subfamilia φ-Herpesviridae destacan el género Lymphocryptovirus, del cual EBV causa la enfermedad de Epstein-Barr. Además, puede provocar linfoma de Burkitt; es oncogénico in vivo.
Su morfología es compleja, y tienen un tamaño de entre 200 y 400 nm. Su genoma es lineal y tiene un tamaño de entre 100 y 300 kb.
Destaca el género Orthopoxvirus, causante de la viruela. Hay al menos 9 especies que causan viruela en humano, pero los más patógenos son el virus vacunal (vaccinia) y el de la viruela (smallpox). La viruela está erradicada desde 1977.
Su morfología es pleomórfica, y tienen un tamaño muy variado, de entre 60 y 220 nm. Su genoma es lineal y tiene un tamaño de entre 27 y 31 kb.
Destaca el género Coronavirus. Las especies más destacadas son SARS-CoV, causante de síndrome respiratorio agudo grave, MERS, causante del síndrome respiratorio de oriente medio, y SARS-CoV-2, causante de COVID-19. Otras especies causan el resfriado común.
Su morfología es icosaédrica regular, y tienen un tamaño de 50 nm. Su genoma es lineal y tiene un tamaño de 11 kb.
Destacan el género Flavivirus, que tiene el virus de la fiebre amarilla y del dengue, y el género Hepacivirus, causante de la hepatitis C (HCV).
Su morfología es esférica, y tienen un tamaño de entre 27 y 34 nm. Su genoma es lineal y tiene un tamaño de entre 6 y 7 kb.
Destacan el género Orthohepevirus, cuya especie Orthohepevirus A es causante de la hepatitis E.
Su morfología es pleomórfica, y tienen un tamaño de entre 125 y 250 nm. Su genoma es lineal y tiene un tamaño de entre 17 y 20 kb.
Destacan el género Morbilivirus, que tiene el virus del sarampión, y el género Rubulavirus, causante de las paperas; ambos dentro de la subfamilia Paramyxovirinae.
Su morfología es variada, si bien a menudo es filamentosa, y tienen un tamaño de unos 80 nm de ancho y más de 150 nm de largo. Su genoma es lineal y tiene un tamaño de unos 19 kb.
Destacan el género Marburgvirus, que provoca la enfermedad de Marburgo, y el género Ebolavirus, causante del ébola.
Su morfología es filamentosa, y tienen un tamaño de entre 80 y 120 nm. Su genoma está dividido en 7 u 8 segmentos.
Los géneros Influenzavirus provocan la gripe. Influenzavirus A produce la gripe A, que afecta a mamíferos y aves; Influenzavirus B produce la gripe B, que afecta solo a mamíferos; Influenzavirus C produce la gripe C, es inocua.
Su morfología es cilíndrica, y tienen un tamaño de unos 70 nm de ancho y unos 200 nm de largo. Su genoma es lineal y tiene un tamaño de unos 11 kb.
Destaca el género Lysavirus, que provoca la enfermedad de la rabia en diversos mamíferos.
Su morfología es esférica, y tienen un tamaño de unos 100 nm. Su genoma es lineal y tiene un tamaño de entre 8 y 11 kb.
Destacan el género Deltaretrovirus, en el que aparece el virus linfotrópico humano de células T (HTLV-1, HTLV-2) y el género Lentivirus en el que aparece el virus de la inmunodeficiencia humana (VIH).
Su morfología es esférica, y tienen un tamaño de entre 42 y 47 nm. Su genoma es circular y tiene un tamaño de entre 3 y 3.5 kb.
Destaca el género Orthohepadnavirus, en el que está HBV, el virus de la hepatitis B. La hepatitis B crónica tiene riesgo de desarrollo de hepatocarcinoma, ya que HBV tiene un oncogén, la proteína X.
Un prion es un agente infeccioso formado solo por aminoácidos, y no contiene material genético. Es una proteína plegada de forma incorrecta con capacidad de trasmitir esa forma mal plegada a otras variedades de la proteína en cuestión. Están asociadas a las encefalopatías espongiformes transmisibles (TSE), un grupo de enfermedades que afectan al sistema nervioso central (SNC) de animales y seres humanos, provocando un deterioro crónico y progresivo, y que son invariablemente mortales.
Sus características recuerdan en algunos casos al Alzheimer, aunque son procesos distintos. Una de las características típicas de estas afecciones es la aparición de acúmulos proteicos en el SNC, además de en el bazo, el hígado, o el riñón. La muerte tisular da lugar a la aparición de "huecos", con apariencia espongiforme. El diagnóstico es complejo, pero la confirmación se obtiene mediante inmunohistoquímica del tejido obtenido post-mortem.
Stanley Prusiner y su grupo obtuvieron por primera vez preparaciones purificadas a partir de tejidos cerebrales de ratones inoculados intracranealmente con el agente productor del Scrapie. Para su sorpresa, dichas preparaciones estaban compuestas exclusivamente por una proteína infecciosa a la que se le acabo dando el nombre de prion.
La proteína de los priones (PrPC, proteína celular de priones) es cifrada por un gen autosómico presente en todos los mamíferos (cromosoma 10 en humanos). El daño provocado por los priones es probablemente debido a la incapacidad de las células nerviosas de degradar y reciclar convenientemente el PrPSC. La clave en el estudio de los priones se obtuvo al determinar la estructura terciaria de PrPC y PrPSC (idéntica secuencia de aminoácidos).
Surge de este modo la ‘’hipótesis de la proteína única’’ para explicar la causa de las enfermedades causadas por priones. Según esta hipótesis, en los tejidos sanos existe una versión normal de la proteína de los priones que presenta una determinada conformación. Por diferentes causas (mutación, infección, o de forma esporádica) la isoforma normal de PrPC cambia su conformación a una isoforma anormal, PrPSC, que no puede ser procesada y degradada, acumulándose en el SNC (y otros órganos). Y, lo que es más importante, en presencia de PrPSC, toda la PrPC cambia a su conformación a PrPSC.
TSEs como enfermedades genéticas. Existen mutaciones en el gen de los priones que promueven o provocan un cambio conformacional hacia la isoforma anormal.
TSEs como enfermedades infecciosas transmisibles. La ingestión de priones (PrPSC) puede provocar TSEs. En el caso de ingestión, provendría del consumo de carne infectada con priones. Los priones atraviesan la barrera gástrica y acabarían llegado sistema nervioso y otros sistemas, donde habría un cambio conformacional en PrPC. No obstante, la probabilidad de infección en principio debería ser baja.
Tembladera (Scrapie). Es una enfermedad neurodegenerativa que afecta a ovejas y cabras. Como síntomas aparecen la tembladera, chasquido de labios, alteraciones en el andar y convulsiones. Además, también se frotan contra árboles o rocas de manera compulsiva, lo que provoca que se les caiga la lana. Esta enfermedad no es transmisible de las ovejas a los humanos.
Encefalopatía espongiforme bovina (EEB). Es más conocida como la "enfermedad de las vacas locas". Se describió por primera vez en ganado vacuno en Reino Unido en 1986. La enfermedad era consecuencia de la alimentación del ganado vacuno con comida contaminada (pienso que provenía de animales afectados por la enfermedad). Para obtener un mayor rendimiento en producción se enriquecía el forraje con proteína procedente de restos de carcasas, vísceras y huesos de otros animales. Su período de incubación es largo, pero cuando los síntomas aparecen, se muestran cambios en el comportamiento, alteraciones en el andar, temblores e hiperactividad ante ciertos estímulos.
Enfermedad de Cretzfeldt-Jacob (ECJ). Es una enfermedad neurológica con 3 variantes: esporádica, herediraria e iatrogénica, o adquirida (proveniente de procesos quirúrgicos o procedimientos clínicos, como la administración de hormonas del crecimiento o por transfusiones de sangre; de hecho no hay pruebas que puedan determinar si la sanfre donada está infectada con el prion o no).
Insomnio familiar fatal (FFI). Es una enfermedad hereditaria, de origen genético, provocada por la mutación D178N del gen PRNP situado en el cromosoma 20. La proteína normal PrP es alterada, y se forma la proteína prion anómala (PRPsc). Casi la mitad de los casos se encuentran en regiones de España: Navarra, País Vasco y Jaén.
Enfermedad de Gerstman-Straussler-Scheneiker (GSS). Enfermedad de origen genético provocada por la mutación P102L en el codón 102 del cromosoma 20.
ECJnv (variante de la EJD). Se inición en Reino Unido y está asociada a consumo de carne de vacuno con EEB.
Kuru. Fue la primera TSE humana que se investigó con detalle. Surgió en 170 tribus de las tierras altas de Papúa Nueva Guinea en los años 50'. La clave para identificar el origen de la enfermedad residió en el perfil de los nativos afectados: muy común en niños y mujeres, pero sin apenas casos en hombres adultos. Esto se debe a que estas tribus practicaban ritos canibalistas (se comían el cerebro de los muertos). Eran las mujeres y los niños quienes quienes comían el cerebro, mientras que los hombres, si se alimentaban de los cadáveres, lo hacian de los músculos.