- Microbiología
- Bacterias
- Eucariotas
- Virus
- Blog
El proceso de fijación del nitrógeno en la naturaleza es llevado a cabo exclusivamente por microorganismos procariotas, así que es una sección del metabolismo microbiano que ya hemos ido analizando.
Índice de contenidos
La fijación de nitrógeno se limita a procariotas, tanto de vida libre como simbióticos. La fijación no está asociada a un metabolismo o modo de vida concreto: encontramos tanto fotótrofos como quimiótrofos que fijan nitrógeno. El N₂ (con valencia 0) deber ser reducido hasta NH₃, del que se forman dos moléculas, antes de su incorporación a componentes nitrogenados de la célula.
Los enzimas encargados son las nitrogenasas, complejos enzimáticos. Las nitrogenasas catalizan la fijación (reducción) del N₂ hasta NH₃. En el proceso se emplean teóricamente 6 electrones (e-), pero en realidad son 8 e-.
Las nitrogenasas tienen sensibilidad extrema al O₂, es decir, se inactivan irreversiblemente en presencia de O₂. Consumen gran cantidad de energía en forma de ATP, por lo que debe de ser aportado de forma continua por un sistema generador de ATP.
Que sea sensible al oxígeno no significa que no se pueda fijar N₂ en el caso de los microorganismos aerobios, ya que éstos han desarrollado mecanismos que permiten aislar a las nitrogenasas de la acción del O₂.
Los mecanismos para fijar N₂ en presencia de O₂ son:
Tampoco la realizan todos los anaerobios.
La fijación no está asociada específicamente con un tipo de metabolismo o de vida concreto, encontramos tanto fotótrofos como quimiótrofos. Los aerobios estrictos fijan nitrógeno siempre que puedan evitar el contacto con el O2. En facultativos pueden fijar nitrogeno en ausencia de oxigeno, y los simbiontes aíslan la nitrogenasa del O2.
| PROCARIOTAS | FOTÓTROFOS | QUIMIÓTROFOS |
| De vida libre: aerobias | Cianobacterias (con heterocistos) | Azotobacter Bacterias metanótrofas Mycobacterium (algunas especies) Thibacillus |
| De vida libre: anaerobias | Cianobacterias Bacterias rojas y verdes | Desulfovibrio Desulfotomaculum Klebsiella (condiciones anóxicas) Clostridium -Arqueas metanogénicas |
| Simbióticas (aisladamente suelen ser aerobias) | Algunas cianobacterias (simbiosis con hongos o helechos) | Azospirillum (con pastos) Rhizobium (con leguminosas, pastos) Francia (con espino, alisos) |
El complejo nitrogenasa consta de 2 componentes:
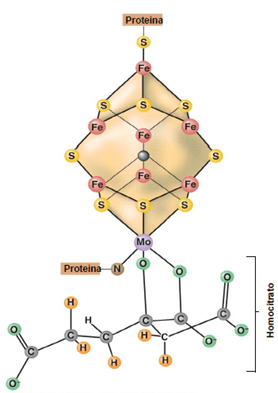
Al juntar ambos componentes se forma el complejo nitrogenasa, cuya esquematización en 3 dimensiones se puede ver en la imagen inferior.
Algunos procariotas fijadores de nitrógeno producen nitrogenasas sin molibdeno (Mo), en condiciones en las que el Mo está ausente o escasea. Contienen vanadio (V) o hierro (Fe): presentan cofactores similares al anterior, pero sin Mo.
No se sintetizan cuando hay suficiente Mo (la que posee este elemento es la nitrogenasa principal). Es como un sistema de seguridad para mantener la fijación de N₂ cuando el Mo escasea en el ambiente.
En Streptomyces thermoautotrophicus la nitrogenasa es insensible al O₂. El componente 2 es una superóxido dismutasa, que convierte el anión superóxido en oxígeno, y actúa conjuntamente con una COdhasa (monóxido de carbono-deshidrogenasa). Es decir, para la fijación de nitrógeno se necesita la producción de O₂. La superóxido dismutasa enlaza la oxidación del CO con la reducción del Componente 1.
La célula necesita ATP y poder reductor para la fijación. Los electrones son transferidos desde una ferredoxina reducida, o ferrosulfoproteínas en general, hasta el componente II (ferroproteína), que se reduce. Paralelamente ocurre una hidrólisis masiva de ATP. Cada dos electrones se consumen 4 ATP.
Al unirse todo el ATP al Componente 2, modifica su conformación y se reduce el potencial redox. Cuando una molécula tiene un potencial redox bajo, tiene mucha capacidad de reducir y liberar e-. Esto lo capacita para reducir al Componente 1, y es aquí donde realmente se produce la reducción de N₂ a NH3, el cual se incorpora a distintos componentes de la célula (especialmente a los ácidos orgánicos).
Se transfieren los electrones al complejo 1, donde se realiza la fijación del N₂ para dar NH₃ y H₂. El nitrógeno tiene un triple enlace y en muy inerte, por lo que es difícil modificarlo (es muy estable). Necedita muchos e- para reducirlo y requiere mucha energía.
En un proceso secuencial, el N₂ se convierte en NH (di-imida) y NH2 (di-amina) antes de pasar a NH3. La reducción del N₂ molecular a NH₃ es bastante endergónica. El N₂ es un gas inerte. Hace falta energía (ATP) para romperlo (reducirlo). Es un proceso costoso y requiere gran gasto de ATP. En el paso de dimida a diamina se incorporan 4 electrones porque simultáneamente se produce H2.
Se necesita:
N2 + 8H+ + 8e - → 2NH3 + H2 (más la hidrólisis de 16-24 ATP, 16 ADP+16P(i))
El ATP procede de diversos procesos como la fermentación, respiración, fotosíntesis, etc. Las cantidades necesarias de ATP y poder reductor son tan importantes que el rendimiento o crecimiento del organismo se ve afectado (es escaso cuando el procariota debe de fijar nitrógeno). Sólo se manifiestan en los estados de rendimiento energético del crecimiento. El suministro de ATP depende del organismo. Cuando la célula necesita fijar N₂ crece menos porque gasta mucha energía.
Si en el ambiente hay NH3 disponible, no se fija N₂. Comparando su crecimiento en un medio con amoníaco (que es el producto final de la fijación del nitrógeno, es decir, el amoníaco es el objetivo por el cual se fija nitrógeno) va a observarse que su crecimiento es mayor; por el contrario, es muy escaso cuando tiene que fijar nitrógeno porque el medio no tiene amoníaco. Ahora bien, si le damos ese amoníaco y no lo tiene que fijar observamos que su crecimiento es mayor. La energía que se ahorra de la fijación se emplea para el crecimiento.
Todos los sistemas de nitrogenasa producen H2, y todas presentan una hidrogenasa ligada a la membrana, lo que puede tener una posible función protectora sobre el sistema nitrogenasa.
La nitrogenasa es sensible a O₂, y la hidrogenasa reduce el O₂ que difunde a la célula. El O₂ pasa a H₂O.
Las reacciones que realiza la nitrogenasa sí son específicas. La nitrogenasa es poco específica a nivel de sustrato: puede trabajar con varios sustratos. Las reducciones no siempre conllevan la transferencia del mismo número de electrones. Un ejemplo es la reducción de acetileno a etileno, con 2H+ y 2e-.
Acetileno (HC≡CH) → Etileno (H2C≡CH2)
Hay otros compuestos que pueden ser reducidos por la nitrogenasa (azida, cianuro, óxido de nitrógeno (NO), nitrilo, etc). Esto es usado para detectar y cuantificar la actividad nitrogenasa de los microorganismos, con el ensayo de reducción de acetileno.
La velocidad de reducción del acetileno a etileno se utiliza en la técnica de ensayo de reducción del acetileno. En este ensayo se incuba una muestra de bacterias con acetileno, y se van tomando muestras cada cierto tiempo de la fase gaseosa. La fase gaseosa de la mezcla de reacción se analiza con un cromatógrafo de gases para cuantificar la producción de etileno.
Si hay nitrogenasa, el acetileno pasa a etileno. Si se observa que al final la cantidad de acetileno es muy baja y la de etileno muy alta es porque el microorganismo tiene una nitrogenasa con cierta actividad.
Las nitrogenasas, y la mayoría de las proteínas reguladoras asociadas a ellas, están codificadas por el regulón NIF. La síntesis de la nitrogenasa tiene una regulación muy estricta: en general, todos aquellos procesos que gastan energía están muy regulados.
La nitrogenasa es sintetizada en aquellas condiciones en las que es necesaria para el crecimiento, es decir, cuando la célula carezca de una fuente utilizable de N₂.
Los dos efectores principales son el oxígeno y las formas de nitrógeno fijado (represores). Las formas de nitrógeno fijado son NH₃, NO₃¯ y algunos aminoácidos. La mayor parte es a nivel transcripcional, es un proceso complejo, con inductores y represores (reguladores positivos y negativos).
También hay mecanismos de “apagado” de la actividad nitrogenasa ya presente (en algunas bacterias):
Los iones NH₄⁺, que es la forma habitual de encontrar el N₂, reprimen la síntesis de nitrogenasa. Cuando la concentración de NH4+ es baja, se activa la transcripción de una proteína positiva de activación del regulón NIF. La célula recibe el aviso de que cuando baja la concentración de amoníaco hace falta fijar N2. Se forma entonces amoníaco, que reacciona con ceto-ácidos para formar aminoácidos. Ese amoníaco, por tanto, no inhibe a la nitrogenasa porque enseguida es utilizado y se incorpora en el biosíntesis.
Cuando su concentración es muy elevada se reprime la síntesis de nitrogenasa. Así no se malgasta ATP cuando hay suficiente amoníaco.
La actividad de la enzima ya presente también puede verse reducida en presencia de NH₄⁺ en algunas bacterias.
Hay al menos 3 rutas de fijación del NH₄⁺:
Piruvato + NH4+ + NAD(P)H + H+ → L-alanina + NAD(P)+ + H2O
α-cetoglutarato + NH4+ + NAD(P)H + H+ → Glutamato + NAD(P)+ + H2O
La capacidad de fijar N₂ se puede transferir entre bacterias mediante contacto directo, por conjugación. Este hecho, y el que los genes NIF, responsables de la fijación de N₂, se sitúen en plásmidos, hacen que se pueda transferir esta capacidad entre bacterias, e incluso de bacterias a organismos eucariotas. Pero, además de la nitrogenasa, existen más requerimientos para la fijación de N₂, como un sistema de ferroproteínas y de protección de la nitrogenasa.