Tras ver la teoría sobre colorantes y tinciones vamos a analizar las principales tinciones usadas en microbiología y los colorantes que las forman.
En este caso, las diferentes técnicas de tinción analizadas se usan para el microscopio óptico. La mayoría de las muestras se podrán ver en el microscopio con aumentos de 20x y 50x, aunque habrán casos donde será necesario usar el aumento 100x (donde se añade también el aceite de inmersión a la muestra).
Las tinciones principales son la de Gram y de Ziehl-Neelsen, ambas diferenciales; aunque también hay otras tinciones diferenciales y selectivas de interés para la microbiología.
Recordatorio: antes de leer este artículo sería bueno que conozcas un poco de teoría sobre las fases, mecanismos y tipos de tinciones que hay (además de las partes que tienen los colorantes). Si conoces todo esto podrás entender mejor ciertas expresiones que son más del gremio 😄.
La tinción de Gram es probablemente la más conocida; es de tipo diferencial y sirve para distinguir a los microorganismos por morfología y composición.
Hay que tener en cuenta que se debe hacer la tinción cuando el cultivo esta en fase exponencial, ya que en fase estacionaria (“vejez”) se pueden confundir las gram positivas con las negativas. Esto ocurre debido a la perdida de capas de peptidoglicano por parte de bacterias gram positivas.
Aparte de estos colorantes, en la tinción de Gram se usará el lugol como mordiente, y alcohol 96% para decolorar. Todas las células (sean Gram positivas o negativas) se teñirán con el cristal violeta.

Ahora bien, el alcohol quita fosfolípidos y cierra los poros de la pared celular, por lo que el cristal violeta queda atrapado. Las bacterias gram positivas podrán soportar este proceso gracias a su gran capa de peptidoglicano. No obstante, las bacterias Gram negativas no aguantarán este tratamiento con alcohol, por lo que se quitará el cristal violeta de ellas.
El proceso de tinción consta de los siguientes pasos:
La principal utilidad de la tinción de Gram es la de distinguir entre bacterias gram positivas y negativas. Las gram negativas que perdieron coloración por el tratamiento con alcohol ahora se verán de color rojo, naranja o rosáceo por acción de la safranina. Por otra parte, las bacterias gram positivas teñidas con cristal violeta tendrán un color azulado o violáceo.
Las siguientes especies son las gram positivas más representativas:
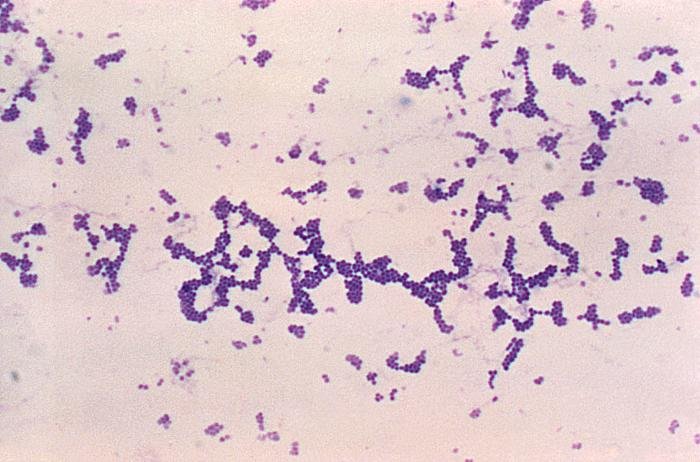
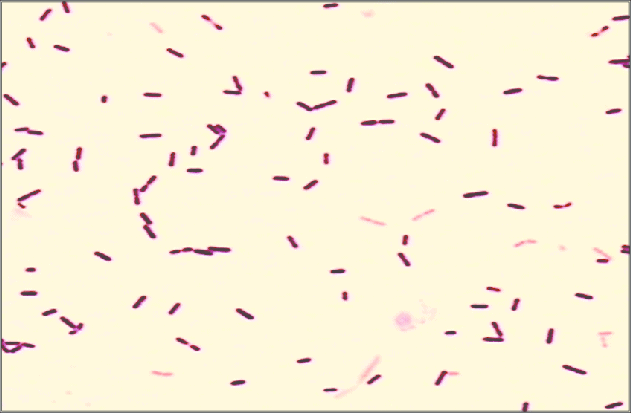
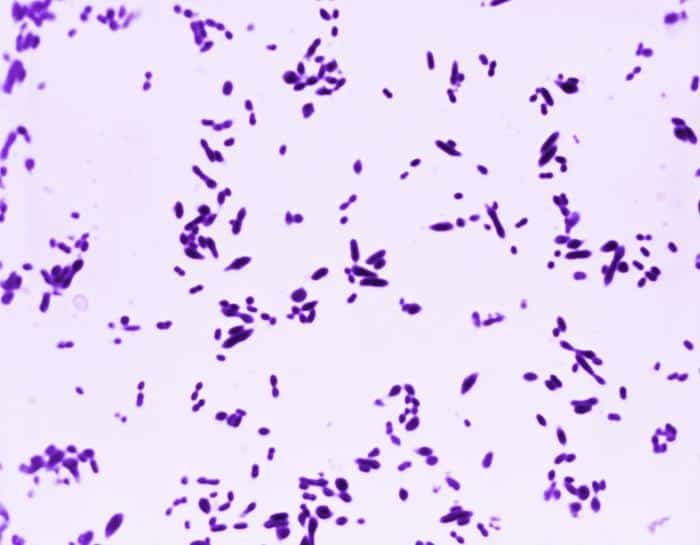
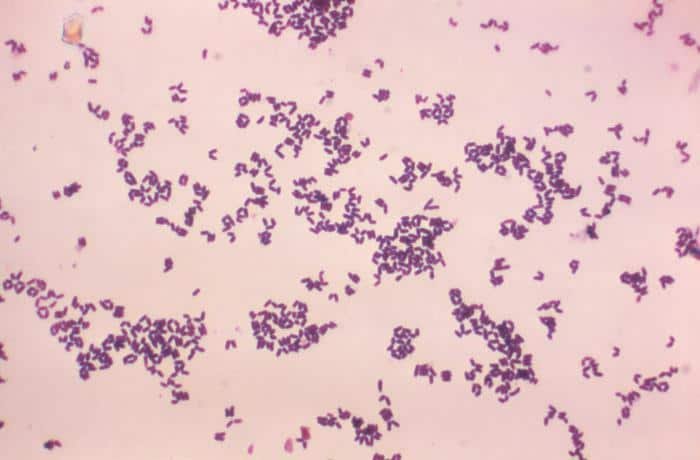

Quizá eches de menos a Mycobacterium tuberculosis. Es cierto, que es una bacteria gram positiva. No obstante, no se detecta bien con la tinción de gram. Hace falta otra tinción diferencial (tinción de Ziehl-Neelsen) que veremos más adelante.
A continuación veremos algunas de las bacterias gram negativas más comunes:
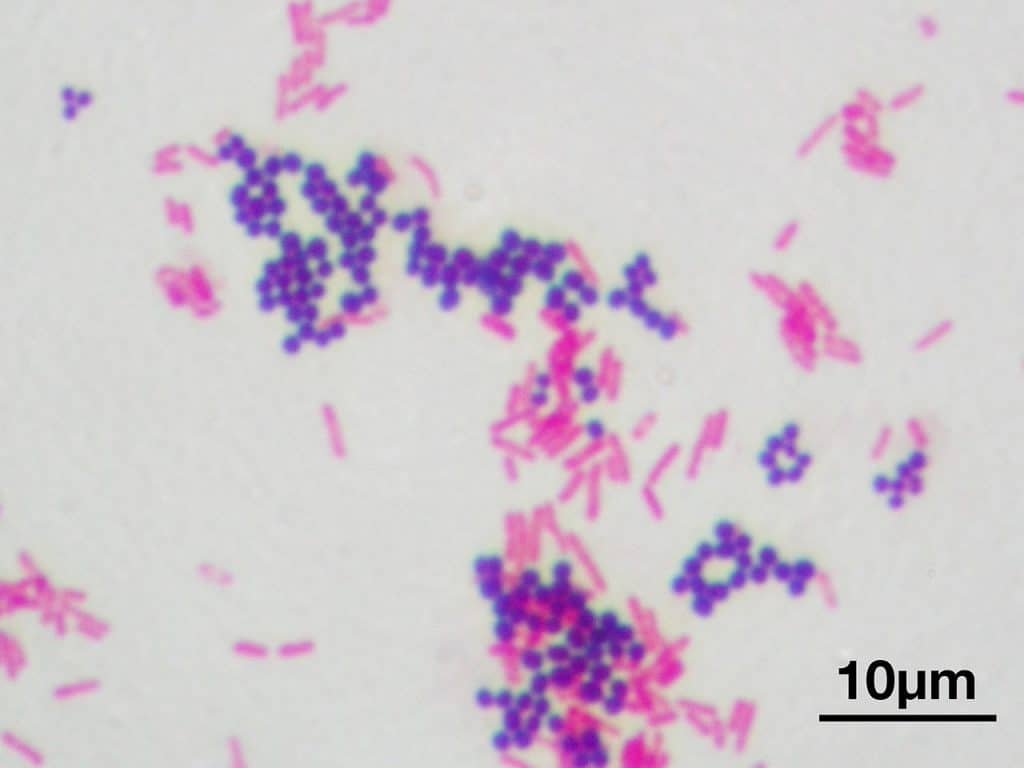
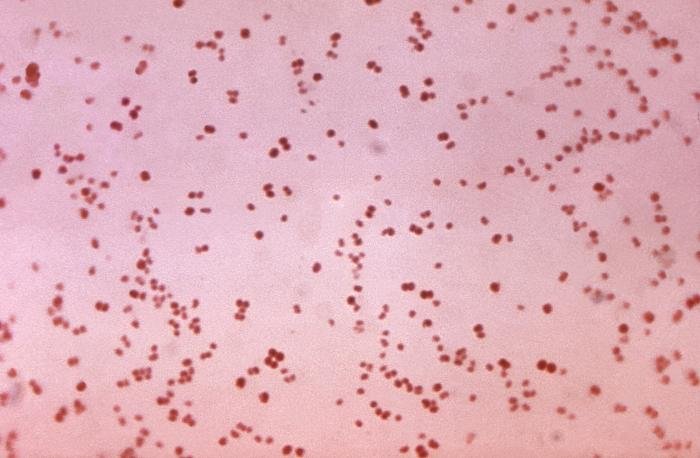
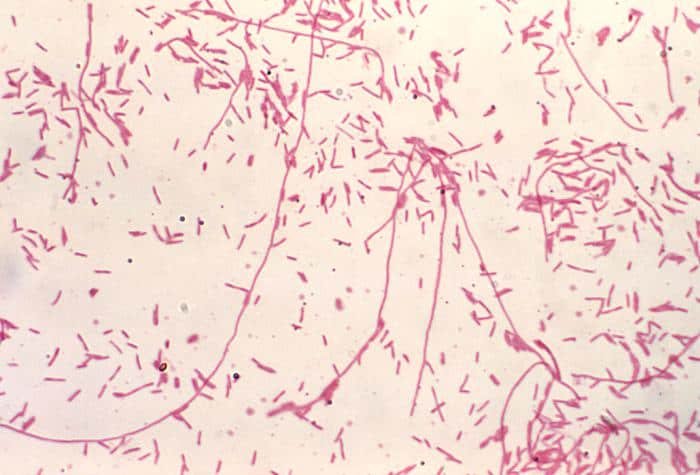

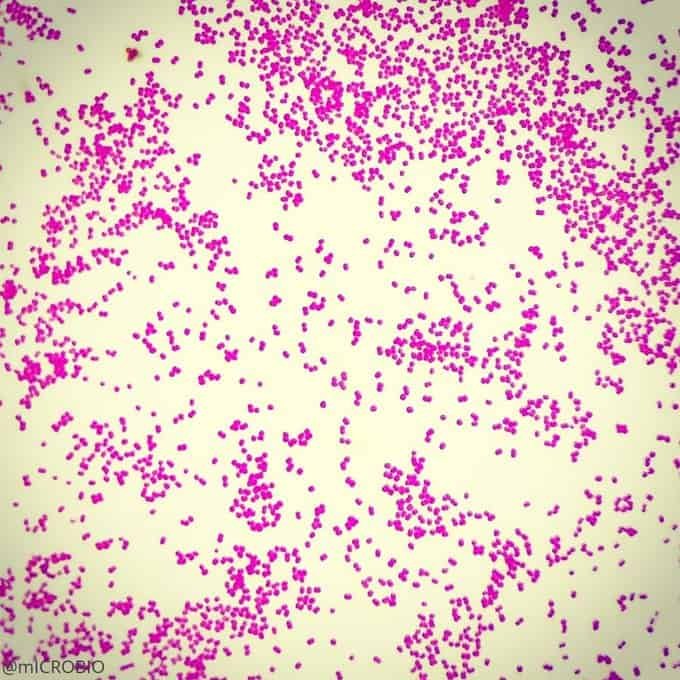
Recordatorio: las bacterias gram positivas se tiñen de azul (azul oscuro o violeta), mientras que las bacterias gram negativas se tiñen de rojo (rojo, anaranjado o rosado). A lo mejor lo tienes claro; pero en mi caso personal casi siempre las confundía. Por eso he puesto el color respectivo en cada frase, para que lo recuerdes mejor si te pasa igual que me pasaba a mí. 😉
La tinción de Ziehl-Neelsen es de tipo diferencial, y sirve para detectar bacterias ácido-alcohol resistentes (BAAR), siendo la más destacada Mycobacterium tuberculosis. Esto es muy útil, sobre todo teniendo en cuenta que M. tuberculosis no puede ser detectada correctamente con la tinción de Gram.
Lo que hace diferentes a estas bacterias es la presencia de un polímero (ácidos micólicos) que se une a azúcares, lo que provoca que el conjunto de la pared sea muy impermeable.
En la tinción de Ziehl-Neelsen, el alcohol-ácido cumple la una función parecida a la del alcohol 96% en la tinción de Gram. En este caso, el contraste aparece por los ácidos micólicos, que hacen que sus bacterias sean impermeables al alcohol-ácido. Las bacterias que no cuenten con estos ácidos micólicos se decolorarán por acción del alcohol, y la fucsina saldrá de éstos.
El proceso de tinción consta de los siguientes pasos:
La principal función de la tinción de Ziehl-Neelsen es la detección de micobacterias, tales como las provocadoras de tuberculosis (M. tuberculosis) o la lepra (M. leprae). También hay otras micobacterias que, si bien no son patógenas, sí que pueden ser patógenos oportunistas en determinadas circunstancias.
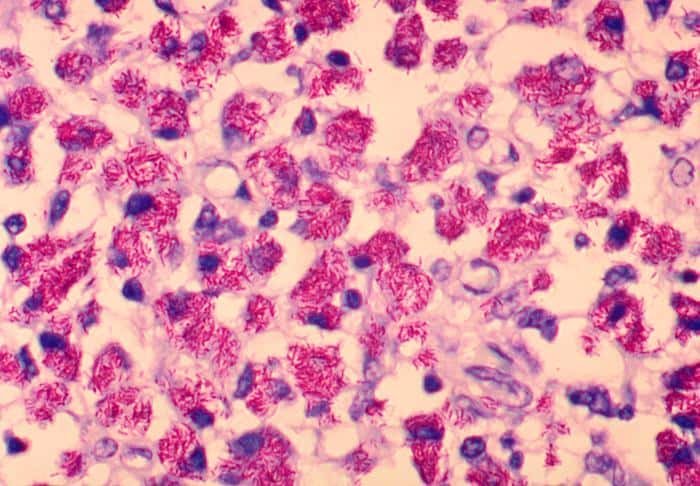
Además, se pueden detectar corinebacterias de gran interés para la biotecnología por su producción de aditivos, o a Streptomyces, formadora de diversos antibióticos. Nocardia y Actinomices también pueden aparecen como bacterias ácido-alcohol resistentes.
Las células bacterianas teñidas con fucsina aparecerán con un color rojo fuego, mientras que las teñidas con azul de metileno tendrán un color azulado.
La tinción de Wirtz-Conklin se usa para observar bien las endosporas bacterianas. La muestra debe ser obtenida de un cultivo en fase estacionaria. En este caso, para su observación al microscopio hay que usar la lente x100, usando aceite de inmersión.
Entra en el grupo de las tinciones selectivas, aunque al añadir un colorante de contraste es tecnicamente una tinción diferencial.
El proceso de tinción consta de los siguientes pasos:
Se usa para observan las endosporas bacterianas, estructuras de resistencia que forman algunas bacterias para sobrevivir en condicione ambientales extremas donde no pueden hacer su ciclo de vida normal. Así, se pueden ver las endosporas que forman Bacillus anthracis y Clostridium perfringens, entre otros.
Las endosporas no absorben la mayoría de los colorantes debido a sus cubiertas gruesas e impermeables. No obstante, el verde malaquita puede hacerlo, por lo que las endosporas bacterianas quedarán teñidas de verde mientras que el resto de las células bacterianas tendrán un color rosáceo.

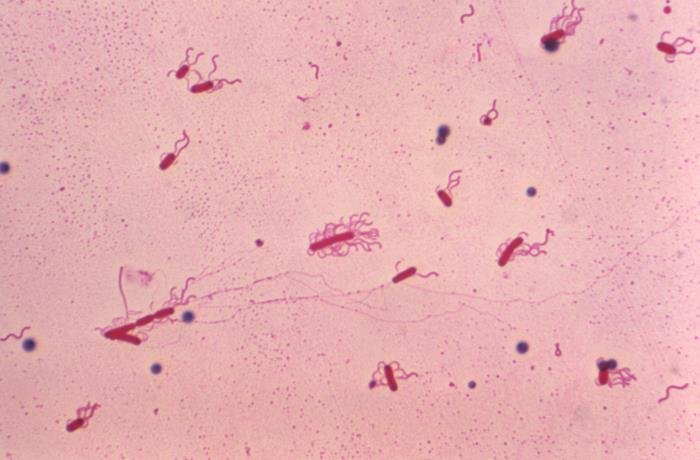
La tinción de Leifson usa para la observación de flagelos bacterianos; entra dentro de las tinciones selectivas. Tienen un espesor de 0.01 micrones, por lo que son invisibles al microscopio óptico; por ello hace falta esta técnica especial. Para su observación en el microscopio óptico, se debe usar aceite de inmersión y el aumento 100x.
Recalcamos el hecho de esta tinción se usa para ver flagelos bacterianos; los flagelos de organismos eucariotas son más gruesos y pueden verse con tinciones simples o incluso con preparaciones al fresco.
Se usa el colorante de Leifson que está formado por:
Las estructuras teñidas aparecen con color rojizo.
El proceso de tinción consta de los siguientes pasos:
Esta tinción se usa para ver a los flagelos, algo esencial para identificar muchas especies. Y es que los flagelos pueden aparecen en número y disposición diferente en las bacterias, de ahí que sean una forma de clasificación de estas (para ver los tipos de bacterias según el número y disposición de flagelos puedes entrar en el artículo de la célula procariota, en la sección “flagelo”).
Esta tinción es más usada en citología, ya que puede discriminar entre zonas con altos contenidos de ADN, por lo que puede diferenciar diversos orgánulos de la célula; es una tinción diferencial. No obstante, también se usa en microbiología para la detección de ciertas bacterias, destacando Rickettsia.
Colorante de Giemsa. Da un color azul oscuro o violáceo al microorganismo objetivo.
El proceso de tinción consta de los siguientes pasos:
En microbiología, la tinción de Giemsa detecta a bacterias como Rickettsia y Chlamydia, a protistas como Plasmodium y Pneumocystis, y ciertos hongos, como Histoplasma. Dichos microorganismos se detectan en posibles células infectadas.

Otro patógeno importante que detecta la tinción de Giemsa es Helicobacter pylori, causante de gastritis y úlceras.

No obstante, esta tinción es más usada en citología.
Se usa para detectar las cápsulas que aparecen en algunas bacterias, así que entra en el grupo de las tinciones selectivas. La tinción negativa se puede usar para el microscopio óptico o para el microscopio electrónico.
Esta técnica se basa en contrastar las muestras mediante una sustancia opaca en ambos microscopios. Ahora bien, para el microscopio óptico se contrasta la muestra a los fotones, mientras que en el microscopio electrónico se constrasta la muestra a los electrones.
Para el microscopio óptico, principalmente pueden ser dos:
Tiñen el fondo de negro.
El proceso de tinción consta de los siguientes pasos:
Si, de todas las tinciones, es el proceso más corto que hemos visto.
La principal función de la tinción negativa es observar las cápsulas bacterianas. Esto ocurre porque las cápsulas no absorben la tinta china, por lo que estas estructuras aparecen como zonas claras en un fondo negro, oscuro.
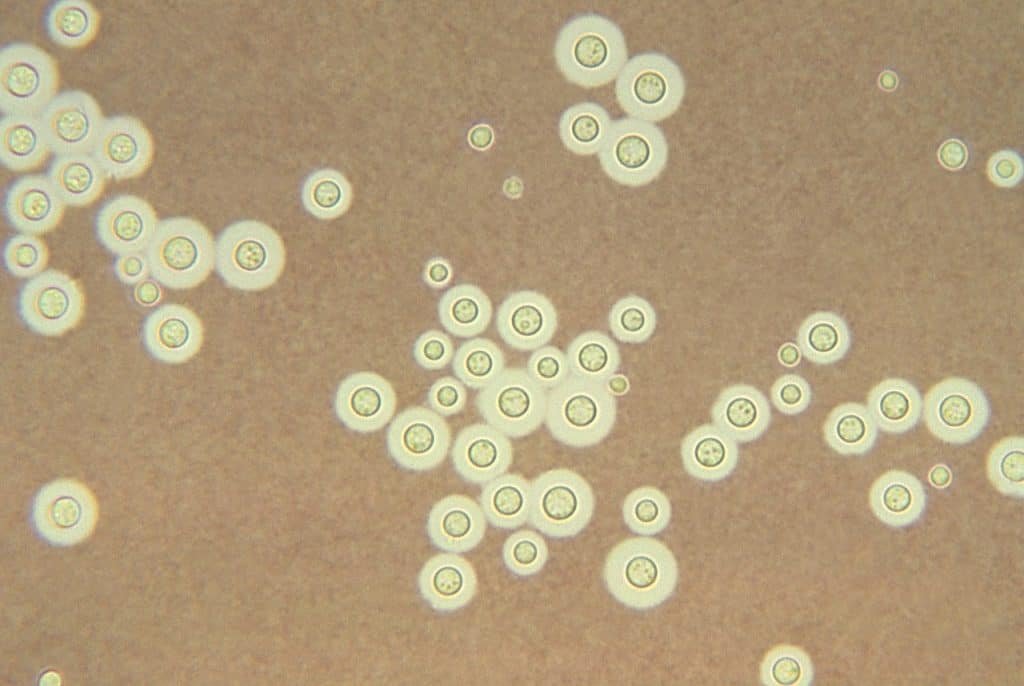
Ahora bien, se pueden añadir algún colorante de contraste para que las células bacterianas sean más visibles. Y, como ya hemos dicho, se puede usar nigrosina en vez de tinta china.