

Tras ver la teoría sobre colorantes y tinciones vamos a analizar las principales tinciones usadas en microbiología y los colorantes que las forman.
En este caso, las diferentes técnicas de tinción analizadas se usan para el microscopio óptico. La mayoría de las muestras se podrán ver en el microscopio con aumentos de 20x y 50x, aunque habrán casos donde será necesario usar el aumento 100x (donde se añade también el aceite de inmersión a la muestra).
Las tinciones principales son la de Gram y de Ziehl-Neelsen, ambas diferenciales; aunque también hay otras tinciones diferenciales y selectivas de interés para la microbiología.
Recordatorio: antes de leer este artículo sería bueno que conozcas un poco de teoría sobre las fases, mecanismos y tipos de tinciones que hay (además de las partes que tienen los colorantes). Si conoces todo esto podrás entender mejor ciertas expresiones que son más del gremio 😄.
La tinción de Gram es probablemente la más conocida; es de tipo diferencial y sirve para distinguir a los microorganismos por morfología y composición.
Hay que tener en cuenta que se debe hacer la tinción cuando el cultivo esta en fase exponencial, ya que en fase estacionaria (“vejez”) se pueden confundir las gram positivas con las negativas. Esto ocurre debido a la perdida de capas de peptidoglicano por parte de bacterias gram positivas.
Aparte de estos colorantes, en la tinción de Gram se usará el lugol como mordiente, y alcohol 96% para decolorar. Todas las células (sean Gram positivas o negativas) se teñirán con el cristal violeta.

Ahora bien, el alcohol quita fosfolípidos y cierra los poros de la pared celular, por lo que el cristal violeta queda atrapado. Las bacterias gram positivas podrán soportar este proceso gracias a su gran capa de peptidoglicano. No obstante, las bacterias Gram negativas no aguantarán este tratamiento con alcohol, por lo que se quitará el cristal violeta de ellas.
El proceso de tinción consta de los siguientes pasos:
La principal utilidad de la tinción de Gram es la de distinguir entre bacterias gram positivas y negativas. Las gram negativas que perdieron coloración por el tratamiento con alcohol ahora se verán de color rojo, naranja o rosáceo por acción de la safranina. Por otra parte, las bacterias gram positivas teñidas con cristal violeta tendrán un color azulado o violáceo.
Las siguientes especies son las gram positivas más representativas:
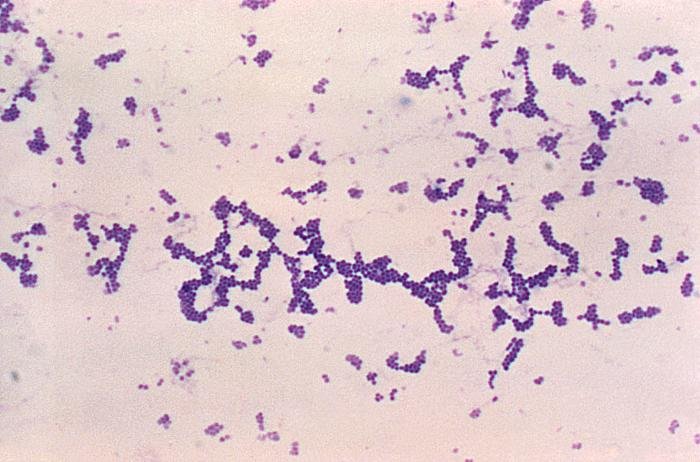
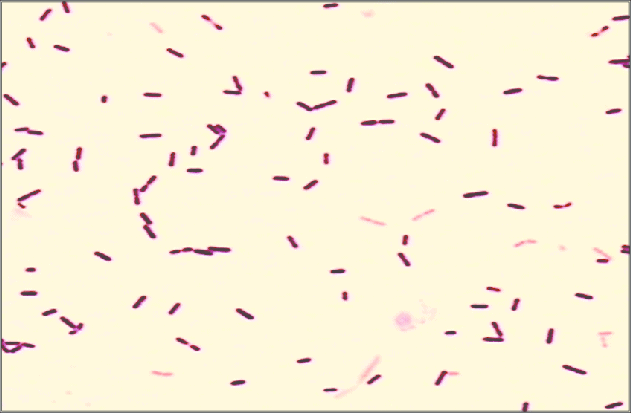
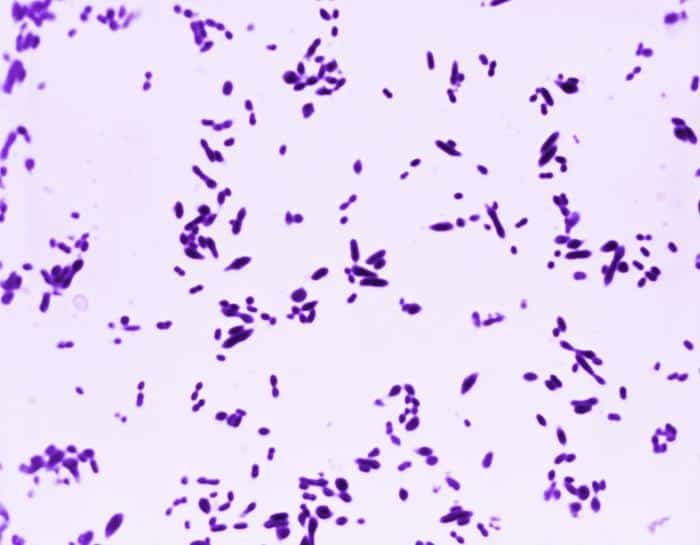
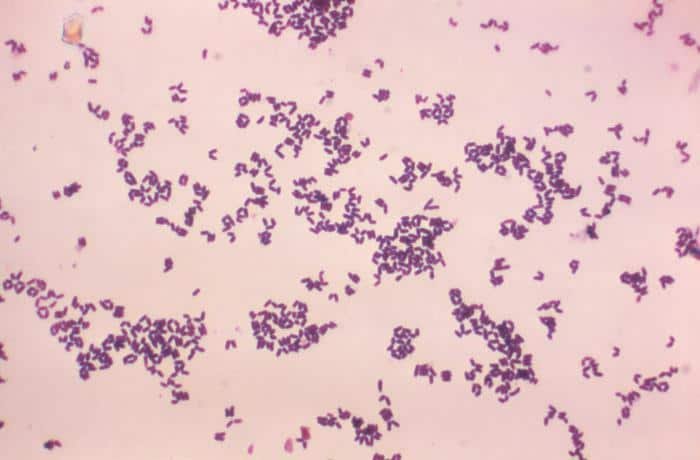

Quizá eches de menos a Mycobacterium tuberculosis. Es cierto, que es una bacteria gram positiva. No obstante, no se detecta bien con la tinción de gram. Hace falta otra tinción diferencial (tinción de Ziehl-Neelsen) que veremos más adelante.
A continuación veremos algunas de las bacterias gram negativas más comunes:
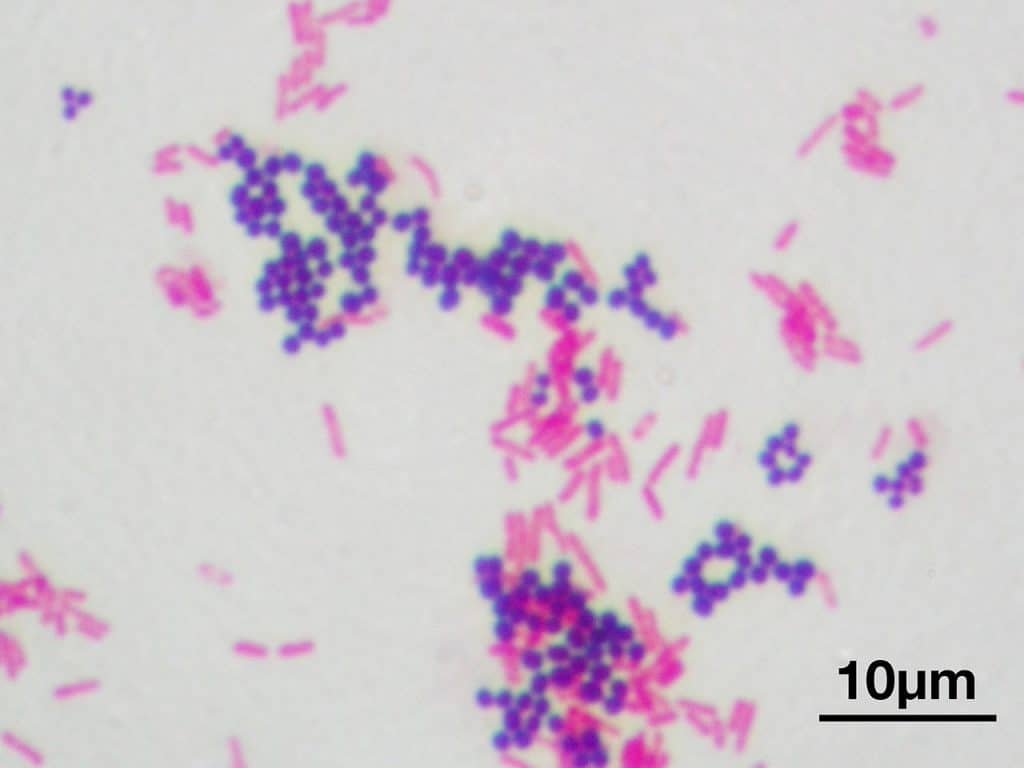
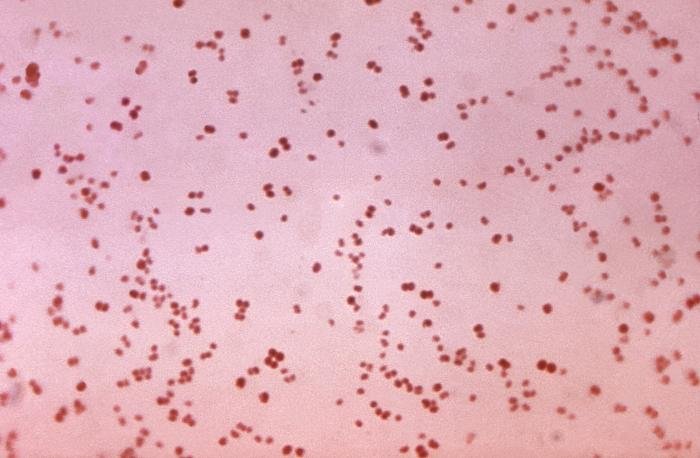
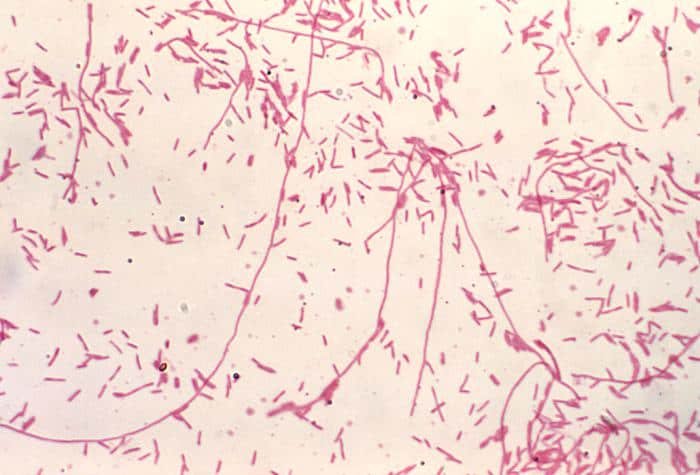

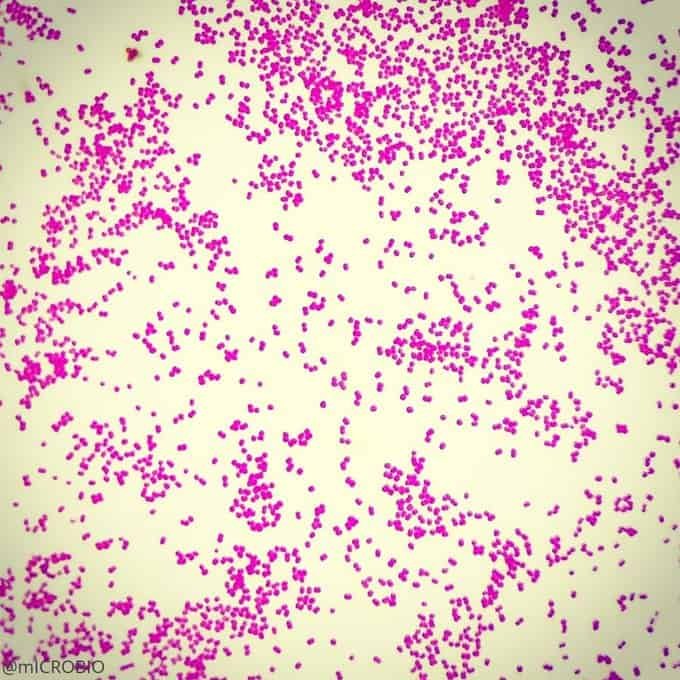
Recordatorio: las bacterias gram positivas se tiñen de azul (azul oscuro o violeta), mientras que las bacterias gram negativas se tiñen de rojo (rojo, anaranjado o rosado). A lo mejor lo tienes claro; pero en mi caso personal casi siempre las confundía. Por eso he puesto el color respectivo en cada frase, para que lo recuerdes mejor si te pasa igual que me pasaba a mí. 😉
La tinción de Ziehl-Neelsen es de tipo diferencial, y sirve para detectar bacterias ácido-alcohol resistentes (BAAR), siendo la más destacada Mycobacterium tuberculosis. Esto es muy útil, sobre todo teniendo en cuenta que M. tuberculosis no puede ser detectada correctamente con la tinción de Gram.
Lo que hace diferentes a estas bacterias es la presencia de un polímero (ácidos micólicos) que se une a azúcares, lo que provoca que el conjunto de la pared sea muy impermeable.
En la tinción de Ziehl-Neelsen, el alcohol-ácido cumple la una función parecida a la del alcohol 96% en la tinción de Gram. En este caso, el contraste aparece por los ácidos micólicos, que hacen que sus bacterias sean impermeables al alcohol-ácido. Las bacterias que no cuenten con estos ácidos micólicos se decolorarán por acción del alcohol, y la fucsina saldrá de éstos.
El proceso de tinción consta de los siguientes pasos:
La principal función de la tinción de Ziehl-Neelsen es la detección de micobacterias, tales como las provocadoras de tuberculosis (M. tuberculosis) o la lepra (M. leprae). También hay otras micobacterias que, si bien no son patógenas, sí que pueden ser patógenos oportunistas en determinadas circunstancias.
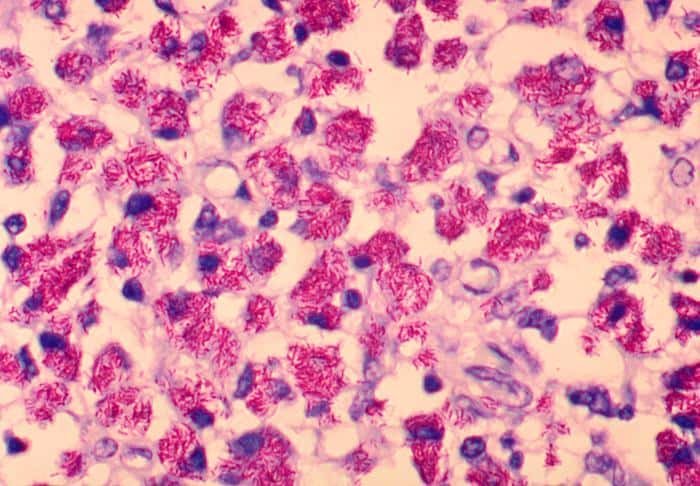
Además, se pueden detectar corinebacterias de gran interés para la biotecnología por su producción de aditivos, o a Streptomyces, formadora de diversos antibióticos. Nocardia y Actinomices también pueden aparecen como bacterias ácido-alcohol resistentes.
Las células bacterianas teñidas con fucsina aparecerán con un color rojo fuego, mientras que las teñidas con azul de metileno tendrán un color azulado.
La tinción de Wirtz-Conklin se usa para observar bien las endosporas bacterianas. La muestra debe ser obtenida de un cultivo en fase estacionaria. En este caso, para su observación al microscopio hay que usar la lente x100, usando aceite de inmersión.
Entra en el grupo de las tinciones selectivas, aunque al añadir un colorante de contraste es tecnicamente una tinción diferencial.
El proceso de tinción consta de los siguientes pasos:
Se usa para observan las endosporas bacterianas, estructuras de resistencia que forman algunas bacterias para sobrevivir en condicione ambientales extremas donde no pueden hacer su ciclo de vida normal. Así, se pueden ver las endosporas que forman Bacillus anthracis y Clostridium perfringens, entre otros.
Las endosporas no absorben la mayoría de los colorantes debido a sus cubiertas gruesas e impermeables. No obstante, el verde malaquita puede hacerlo, por lo que las endosporas bacterianas quedarán teñidas de verde mientras que el resto de las células bacterianas tendrán un color rosáceo.

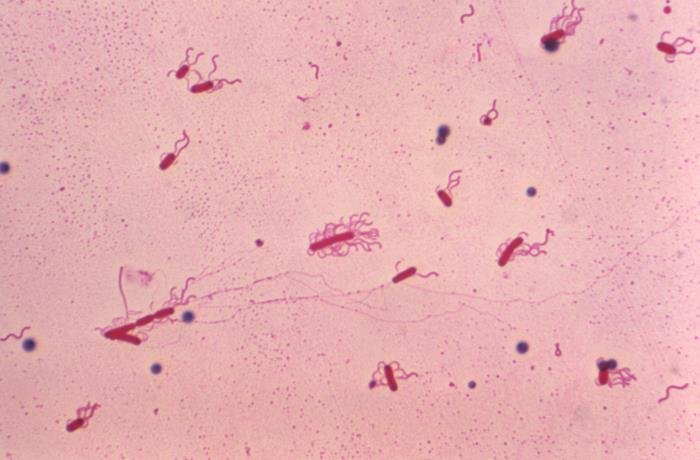
La tinción de Leifson usa para la observación de flagelos bacterianos; entra dentro de las tinciones selectivas. Tienen un espesor de 0.01 micrones, por lo que son invisibles al microscopio óptico; por ello hace falta esta técnica especial. Para su observación en el microscopio óptico, se debe usar aceite de inmersión y el aumento 100x.
Recalcamos el hecho de esta tinción se usa para ver flagelos bacterianos; los flagelos de organismos eucariotas son más gruesos y pueden verse con tinciones simples o incluso con preparaciones al fresco.
Se usa el colorante de Leifson que está formado por:
Las estructuras teñidas aparecen con color rojizo.
El proceso de tinción consta de los siguientes pasos:
Esta tinción se usa para ver a los flagelos, algo esencial para identificar muchas especies. Y es que los flagelos pueden aparecen en número y disposición diferente en las bacterias, de ahí que sean una forma de clasificación de estas (para ver los tipos de bacterias según el número y disposición de flagelos puedes entrar en el artículo de la célula procariota, en la sección “flagelo”).
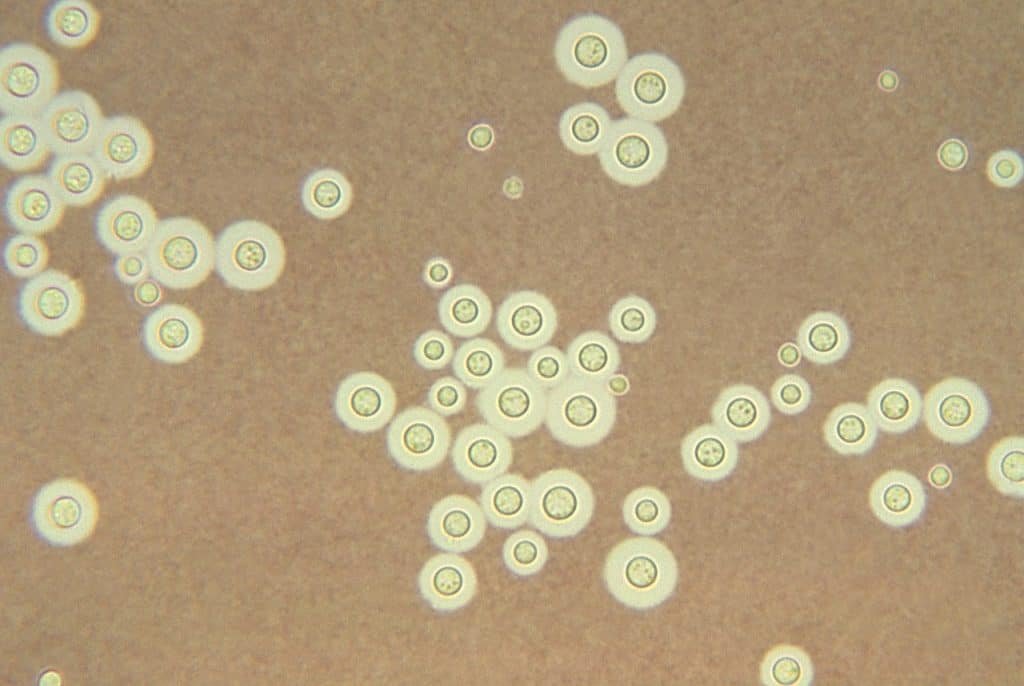
Esta tinción es más usada en citología, ya que puede discriminar entre zonas con altos contenidos de ADN, por lo que puede diferenciar diversos orgánulos de la célula; es una tinción diferencial. No obstante, también se usa en microbiología para la detección de ciertas bacterias, destacando Rickettsia.
Colorante de Giemsa. Da un color azul oscuro o violáceo al microorganismo objetivo.
El proceso de tinción consta de los siguientes pasos:
En microbiología, la tinción de Giemsa detecta a bacterias como Rickettsia y Chlamydia, a protistas como Plasmodium y Pneumocystis, y ciertos hongos, como Histoplasma. Dichos microorganismos se detectan en posibles células infectadas.

Otro patógeno importante que detecta la tinción de Giemsa es Helicobacter pylori, causante de gastritis y úlceras.

No obstante, esta tinción es más usada en citología.
Se usa para detectar las cápsulas que aparecen en algunas bacterias, así que entra en el grupo de las tinciones selectivas. La tinción negativa se puede usar para el microscopio óptico o para el microscopio electrónico.
Esta técnica se basa en contrastar las muestras mediante una sustancia opaca en ambos microscopios. Ahora bien, para el microscopio óptico se contrasta la muestra a los fotones, mientras que en el microscopio electrónico se constrasta la muestra a los electrones.
Para el microscopio óptico, principalmente pueden ser dos:
Tiñen el fondo de negro.
El proceso de tinción consta de los siguientes pasos:
Si, de todas las tinciones, es el proceso más corto que hemos visto.
La principal función de la tinción negativa es observar las cápsulas bacterianas. Esto ocurre porque las cápsulas no absorben la tinta china, por lo que estas estructuras aparecen como zonas claras en un fondo negro, oscuro.
Ahora bien, se pueden añadir algún colorante de contraste para que las células bacterianas sean más visibles. Y, como ya hemos dicho, se puede usar nigrosina en vez de tinta china.
El phylum Actinobacteria (actinobacterias o actinomicetos) es extenso y complejo: está formado por 1 clase, 6 órdenes y 44 familias taxonómicas. Son bacterias GRAM+ con alto contenido en G+C.
Son actinomicetos (filamentosos, frecuentemente ramificados) y parientes con un alto contenido G+C (>50% mol). Respecto a su morfología, podemos decir que suelen ser bacilos o filamentos principalmente aerobios. Su hábitat son suelos y material vegetal.
En su mayoría son comensales inofensivos, aunque Corynebacterium, Nocardia y Mycobacterium contienen importantes patógenos para los seres humanos. Hay un interés economico en estos, ya que algunos producen antibióticos, o productos lácteos fermentados.
Se agrupan en cocos (parejas, tétradas o agrupaciones irregulares) y tienen alto contenido en G+C. Son gram positivos (+) y catalasa (+). Suelen ser inmóviles. Siempre son cocos, y sus colonias están pigmentados por carotenoides (amarillo, naranja o rojo). Están ampliamente extendidos en el suelo, el agua y sobre la piel de mamíferos.
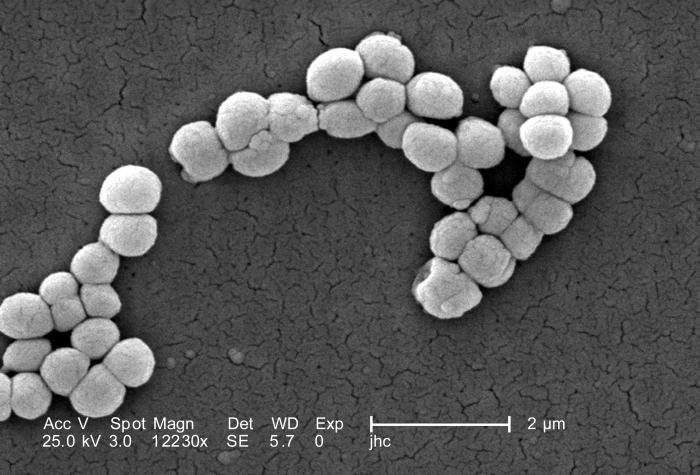
También denominadas bacterias corinefoides. Son bacilos móviles con un crecimiento con forma irregular (letras chinas, mazo, forma de V) que se debe a una división crepitante/angular/por fractura que produce un movimiento de desgarro cuando se dividen (la membrana tiene 2 capas). Ambas bacterias quedan unidas por la pared externa y el septo que las separa es la pared interna. Después, se rompe la capa externa en un lado sólo y quedan como una bisagra.
Este género es anaerobio facultativo siempre catalasa +. Respira O2 (respiración aerobia) y la fermentación es propiónica, sin O2. Presenta ácidos micólicos (3-hidroxiácidos ramificados) pero no son ácido-alcohol resistentes (tinción Ziehl-Neelsen).
Respecto a las especies principales de Corinebacterium podemos destacar:
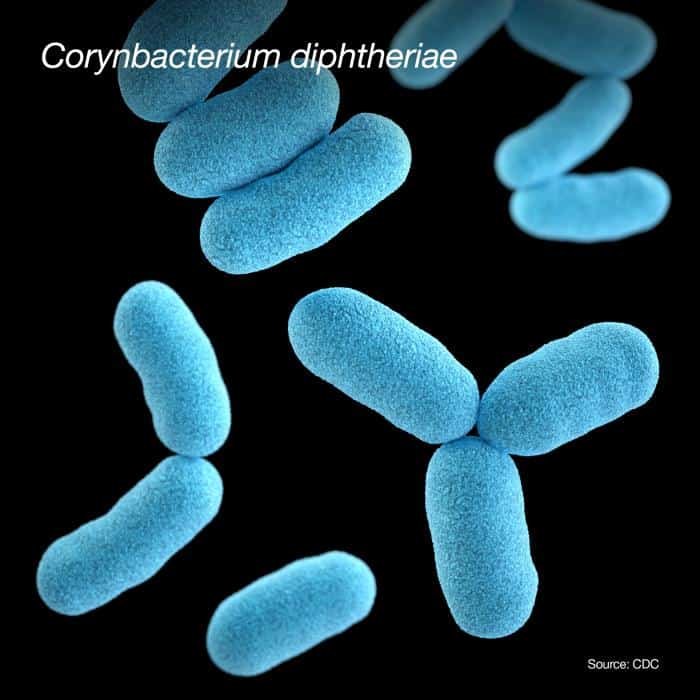
Es la principal causa de difteria. Se utiliza agar telúrito (agar cistina-TeO3K) para su aislamiento. Este agar inhibe el crecimiento de cualquier muestra nasofaringial. Forma colonias negras en agar telúrito y blancas en agar-sangre.
La toxicidad de esta bacteria es por la exotoxina diftérica. La toxina la codifica el fago β que contiene el gen tox. Hay conversión lisogénica (genes del fago alteran el fenotipo de la bacteria hospedadora). Las cepas no lisogénicas son atóxicas, no producen la enfermedad. Por otro lado, las cepas virulentas son así por la presencia del fago en estado lisogénico.
La expresión del gen tox depende del estado fisiológico de la bacteria. La presencia de hierro es un condicionante. El gen se expresa cuando los niveles de hierro son bajos, debido a que su alta concentración inhibe la expresión del gen.
La exotoxina entra en las células e inhibe el EF2 de las células (inhibe la traducción) impidiendo la unión del aminoácido a la cadena de aminoácidos nacientes. No se consiguen formar proteínas por lo que la célula muere. Cuando se produce la exotoxina ésta pasa al torrente sanguíneo pero la bacteria se queda en la boca y provoca la pseudomembrana diftérica por falta de O₂.
Existen 3 biotipos:
Es aerobio estricto, por lo que en la pruebas es catalasa +. Presenta dimorfismo. En la fase exponencial se muestra como un bacilo. Tiene división crepitante formando ramificaciones irregulares de aspecto poco filamentoso. También presenta fragmentación múltiple. En fase estacionaria, tiene forma de cocos que se diferenciarán hasta bacilos.
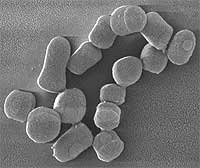
Es un importante agente mineralizador de la materia orgánica en el suelo; muy resistente a la desecación y a la privación de nutrientes. Está adaptado a este medio. Tiene una extraordinaria flexibilidad nutricional poco común al degradar pesticidas, algo muy inusual.
Tiene una morfología similar a corinebacterias (es un género muy pleomórfico). Puede denominarse corinebacteria anaerobia. Es anaerobio aerotolerante: siempre presenta fermentación propiónica (tiene pigmentos hémicos, citocromos, catalasa, etc). Es prácticamente anaerobio en cuestiones de O₂ ya que vive en lugares con presión parcial de O₂ baja. Tiene cadena de transporte de electrones (CTE) por lo que sería más correcto denominarlo anaerobio facultativo.
Su hábitat son los ambientes con bajas presiones parciales de O₂: tracto intestinal, genital, rumen y piel (Propionibacterium acnes), además de productos lácteos. De hecho, la primera vez que se aisló fue a partir de un queso suizo.
Fermenta azúcares y produce propionato, acetato, CO₂ y ± succinato. Los productos de su fermentación son utilizados por otros microorganismos para realizar la fermentación láctica. Puede fermentar lactato (fermentación secundaria).
Ciclo del propionato:
1 glucosa → 2 piruvato → 2 propionato.
A partir de lactato:
3 lactato → 3 piruvato → 2 propionato + 1 acetato + 1 CO₂
Formación de succinato:
fosfoenolpiruvato (PEP) + CO₂ → oxalacetato →→→ succinato
Es causante del acné. Hay una producción alta de sebo por la actuación de hormonas y la presencia del microorganismo que segrega lipasas que lo degradan. Los productos generan inflamación al atravesar la dermis. Actualmente es denominado Cutibacterium acnes.

Es un género diferente: son bacilos inmóviles aislados, o en parejas en forma de V o grupos, con extremos espatulados, y en muchos casos bifurcados.
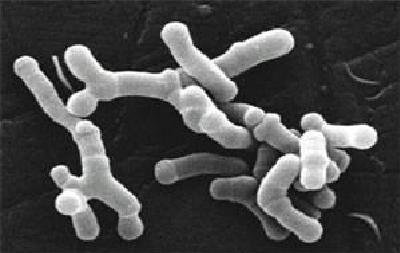
Son anaerobios estrictos o anaerobios aerotolerantes (según la especie): soportan O₂ siempre que haya CO₂.
Es una fracción mayoritaria de la microbiota intestinal natural del recién nacido alimentado con leche materna. En el adulto, se encuentra en el intestino y en la boca. También aparece en otras especies, aguas residuales e insectos.
Necesita de aminoazúcares presentes en la leche (N-acetilglucosamina y N-acetilgalactosamina); si le faltan estos aminoazúcares cambian su morfología creando ramificaciones que dan lugar a un micelio rudimentario. El metabolismo de estas bacterias es similar al de las fermentadoras del ácido láctico. El lactato formado a partir de los aminoazúcares no se forma igual que en las fermentadoras del ácido láctico (realizan una fermentación via pentosas-fosfato).
2 glucosa → 3 acetato + 2 lactato (5 ATP) (no suelen producir CO2)
Son bacilos inmóviles aerobios, y presentan crecimiento filamentoso transitorio (fase estacionaria) que se rompe cuando llegan a la fase exponencial.
Tienen un alto contenido en lípidos en su pared (AAR, ácido-alcohol resistentes). Los lípidos son ácidos micólicos, lípidos de 60-90 carbonos con otros en posición 3-OH que dan lugar a los 3-hidroxiácidos grasos ramificados. Los ácidos micólicos les confieren un aspecto denso, compacto, céreo y rugoso a las colonias en medio sólido. En medio líquido forman grumos. Además, reducen la permeabilidad, aumentan la resistencia a la desecación y a agentes microbianos.
La presencia de ácidos micólicos es una propiedad extraña para el resto de bacterias excepto para bacterias no cardiformes y micobacterias. El tamaño de los ácidos es proporcional a la resistencia. También tienen una importante aplicación clínica en la detección de especies patógenas.
Velocidad de crecimiento
Pigmentación (carotenoides)
Presenta crecimiento lento y es patógena del hombre. Es resistente a los germicidas y a pH alcalinos (aislamiento selectivo). Con estas características se pueden preparar medios selectivos.
Existe una correlación con la creación de formas de cordón al generarse por la agregación de estas bacterias (que forman cadenas alargadas) con la presencia de glicolípido; factor cuerda, responsable de esta formación, y de su virulencia (inhibe el paso de unión del fagosoma con el lisosoma).
Son quimioheterótrofos y Gram positivos (+). Respecto a su morfología podemos decir que tienen un crecimiento ramificado similar al de los hongos filamentosos.
El método reproductivo es asexual por crecimiento apical de hifas. Se forman tabiques en el micelio que dan lugar a las esporas: conidiosporas (conidios) o esporangiosporas. Ambas son exosporas asexuales.
Su disposición y morfología tiene carácter sistemático. Se desarrollan por privación de nutrientes. No soportan las altas temperaturas, pero sí la desecación.
La mayoría son inmóviles. Las esporas se transportan por viento o animales. Cuando hay movimiento, éste se limita a las esporas que presentan flagelos.
La pared celular es muy variada (60 unidades de peptidoglicano (PG); respecto al tercer aminoácido que ocupa lugar en la cadena de aminoácidos lo hace por puente intrapeptídico). El tipo de pared celular es un criterio taxonómico, que los divide en 4 grupos.
El porcentaje de G+C que presentan estas bacterias es del 63-78%. Tienen el contenido más alto en G+C. Se les considera un grupo muy coherente.
Viven libres, en el suelo, donde degradan grandes cantidades y variedades de compuestos orgánicos. Son esenciales en la mineralización de la materia orgánica. Además, se encuentran en la piel, y algunos pueden ser patógenos para el hombre, otros animales y algunas plantas.
Producen metabolitos secundarios con gran interés práctico: son los mayores productores de antibióticos junto con Bacillus y hongos eucariotas. Producen también fármacos anticancerígenos, antihelmínticos e inmunosupresores (útiles en procesos de transplante de órganos).
Cuenta con un micelio aéreo limitado (a partir de él pueden producir conidios) y es de sustrato fragmentable. Es una bacteria aerobia, catalasa +. Además, tiene la capacidad de usar una gran variedad de hidrocarburos, azúcares y ceras.
En la pared celular tiene peptidoglicano con mDAP y sin puente peptídico de unión. Posee ácidos micólicos (AAR).
Son saprófitos de vida libre, en suelos y aguas (deterioro de juntas de goma en tuberías de agua).
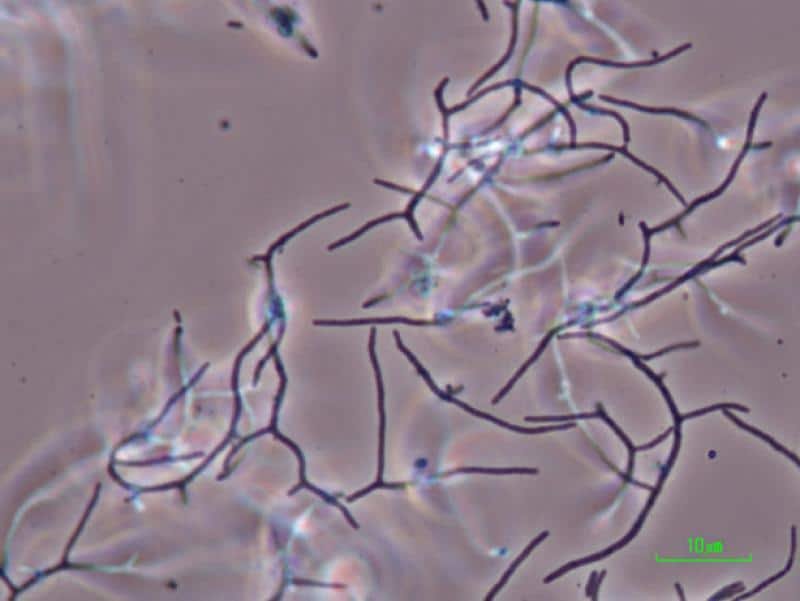
Nocardia asteroides. Es una bacteria patógena oportunista que afecta al hombre y otros animales en diferentes órganos. Pueden centrarse en alguno, como por ejemplo en pulmón, causando la nocardiosis pulmonar crónica que es difícil de tratar.
Cuenta con más de 500 especies. Tienen un %GC de entre 69-78%. Forman colonias compactas. Las especies se establecen mediante características morfológicas y fisiológicas. Son aerobios estrictos.
Cuentan con micelio aéreo y de sustrato (no fragmentable). Sus filamentos son de 0,5-1µm Ø y longitud indefinida, y a menudo, sin septos en fase vegetativa.
Forman conidiosporas inmóviles en el extremo de las hifas aéreas (3 → 50) formadas a partir de esporóforos multinucleados, y hay una posterior separación de las células individuales.

La forma, textura y disposición de las esporas se utiliza como carácter taxonómico. Hay pigmentación de esporas y esporóforos. A veces, el micelio de sustrato también está pigmentado.
Este género es de fácil identificación en placa: tiene aspecto pulverulento, naturaleza compacta y color. Presentan enzimas hidrolíticos que degradan gran cantidad de compuestos. Son muy versátiles y adaptables. Cuentan con hidrolasas extracelulares de compuestos inusuales.
Esporulan sobre sustratos sólidos (agar) o en la superficie de cultivos líquidos sin agitación. Sólo colonizan medio sólido.
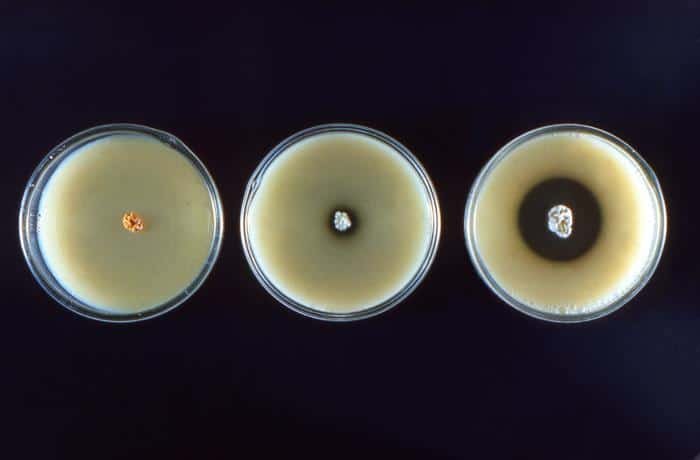
Su hábitat es principalmente de suelos (alcalinos y neutros), y son de fácil aislamiento Producen geosminas. A excepción de las especies que se citarán a continuación, el resto son inocuas:
El género Streptomyces fabrica muchísimos antibióticos (±50%); cuenta con más de 10000 compuestos diferentes con actividad biológica. Producen ±2/3 partes de los agentes antimicrobianos empleados en medicina y veterinaria.
Algunos sintetizan más de 1 antibiótico, y a menudo, sin relación química. El mismo antibiótico puede ser producido por diferentes especies muy alejadas entre sí. Un cambio nutricional puede causar un cambio en la naturaleza del antibiótico. La bacteria productora resiste a su propio antibiótico pero puede ser sensible a otros.
Hay especies de Streptomyces con plásmidos lineales (500kb de longitud), implicados en la biosíntesis de antibióticos.
La búsqueda de nuevos antibióticos prosigue: el desarrollo de cepas resistentes requiere el descubrimiento continuo de nuevos agentes. Se ha usado la tecnología informática para encontrar nuevos antibióticos a partir de especies que ya conocemos; además de comprobar otras alternativas usadas en el pasado, como la terapia con bacteriófagos.
No se saben las razones ecológicas por las cuales llevan a cabo la producción de antibióticos. Se producen en fase estacionaria, por lo que no intervienen en el crecimiento, así que se cree que promueven la esporulación para incrementar sus posibilidades de supervivencia.
En el siguiente recuadro se pueden ver una serie de especies de Streptomyces con su correspondiente antibiótico generado y su diana celular.
| Microorganismo | Antibiótico | Estructura química | Diana celular |
|---|---|---|---|
| S. griseus | Estreptomicina | Aminoglucósido | 30S |
| S. orientalis | Vancomicina | Carboxiglicósido | Pared celular |
| S. venezuelae | Cloranfenicol | Derivado del benceno | 50S |
| S. mediterranei | Rifampicina | Ansamicina | RNA-pol del DNA |
| S. fradiae | Neomicina | Aminoglucósido | 30S |
| S. kanamyceticus | Kanamicina | Aminoglucósido | 30S |
| S. erythraeus | Eritromicina | Macrólido | 50S |
| S. aureofaciens | Tetraciclina | Tetraciclina | 30S |
El análisis filogenético divide a las GRAM(+) en dos grandes grupos: las que tienen alto contenido en G+C y las que tienen bajo contenido en G+C. Dentro de las GRAM(+) de bajo contenido C+G encontramos a firmicutes y molicutes:
Se caracterizan por ser todas oxidasa (-): ninguna es aerobia estricta. Staphyllococcus y Listeria son catalasa (+), mientras que las acidolácticas son catalasa (-) pero oxidasa (+) y peroxidasa (+).
Es anaerobio facultativo: con oxígeno respira, sin oxígeno presenta fermentación ácido-láctica. Es catalasa(+) y oxidasa(-). Son cocos inmóviles y forman agrupaciones irregulares; no siempre usan el mismo plano de división y forman racimos.
Son halotolerantes, por eso pueden vivir en ambientes salinos con bajo contenido hídrico y baja concentración osmótica, como por ejemplo en la piel, las mucosas o las glándulas de humanos o de otros animales. Estos ambientes tienden a inhibir el crecimiento de la mayoría de microorganismos, aunque no es su caso. Esta capacidad de vivir en medios de alta concentración de sal permite el fácil aislamiento de estos microorganismos: se inocula la muestra en una placa con medio rico en nutrientes con una concentración salina del 7% y condiciones aerobias. La mayoría de las colonias serán cocos GRAM positivos (+).
Muchas especies son pigmentadas por la presencia de carotenoides, protegen frente a los efectos antimicrobianos de la luz solar y parecen estar implicados en la defensa frente a los fagocitos. Estas células destruyen al patógeno produciendo especies reactivas del oxígeno (ROS). Los carotenoides secuestran el oxígeno en estado singlete (con dos electrones apareados en el orbital de energía más alta) y evitan su destrucción. Además estos pigmentos ayudan a su distinción.
Puede considerarse como comensal o como parásitos en mucosas, piel y glándulas del hombre u otros animales de sangre caliente (homeotermos). Hay algunos que son patógenos potenciales y causan una infección o intoxicación alimentaria. La infección implica la invasión del hospedador mientras que la intoxicación es solo por toxinas.
Hay dos especies destacadas:
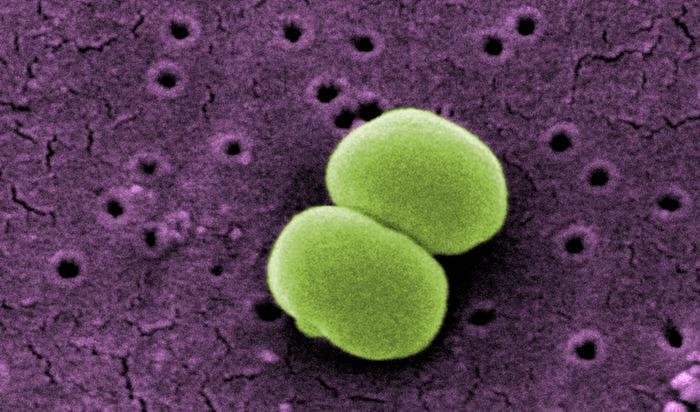
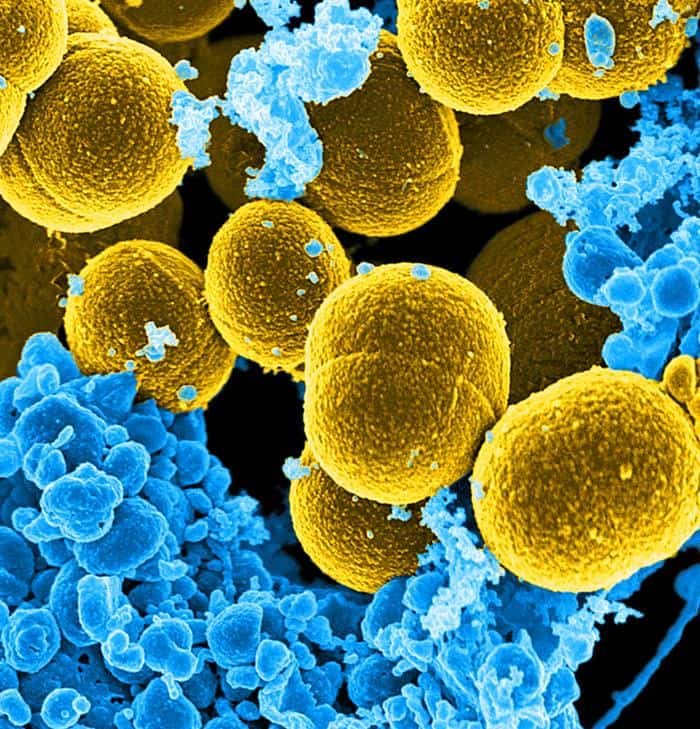
Su patogenicidad se debe a muchas exotoxinas entre otras:
Algunas exotoxinas se relacionan con plásmidos como la hemolisina, fibrinolisina, enterotoxina, etc.
Pueden ser bacilos o cocos, generalmente inmóviles. Producen ácido láctico como principal o único producto de la fermentación (homo- y heterofermentadores). Siempre fermentan. Son oxidasa (-), catalasa (-) y peroxidasa (+). Son anaerobios aerotolerantes, por lo que son oxidasa(-), pues no tienen cadena de transporte de electrones (CTE) ni citocromos.
Se aíslan fácilmente, adicionando a un medio azida sódica (inhibe la CTE, inhibe la respiración). En condiciones aeróbicas y presencia de azida sódica, los anaerobios facultativos mueren, pero estos la usarán en la fermentación y no se ven afectados al no tener CTE.
Obtienen ATP por fosforilación a nivel de sustrato. La mayoría sólo pueden metabolizar azúcares y están restringidas a ambientes con azúcares disponibles. Son nutricionalmente exigentes y se les debe suministrar vitaminas, aminoácidos, bases nitrogenadas, debido a su limitada capacidad biosintética.
Se puede distinguir entre homo y heterofermentadores:
Leuconostoc puede formar parejas. Se aísla de plantas, ensilados (forma de conservar el forraje de los animales), leche y derivados. Se puede emplear en elaboración de alimentos y bebidas, encurtidos, vinos, quesos, etc. Es heterofermentativo.

Leuconostoc mesenteroides es una especie muy conocida, sintetiza dextranos a partir de sacarosa, éstos se depositan en la cápsula. Es importante en la producción industrial de dextranos. Algunas especies están implicadas en descomposición de alimentos. Tolera elevadas concentraciones de azúcar, lo que facilita su desarrollo en jarabes como el almíbar, problema importante en refinerías de azúcar.
Son homofermentadoras, pero con hábitats y modo de vida actividades muy diferentes entre las diferentes especies. Algunas con importancia clínica, otras industriales y alimentarias. Hace años, el género se diversificó en otros géneros: Enterococcus, Lactococcus.
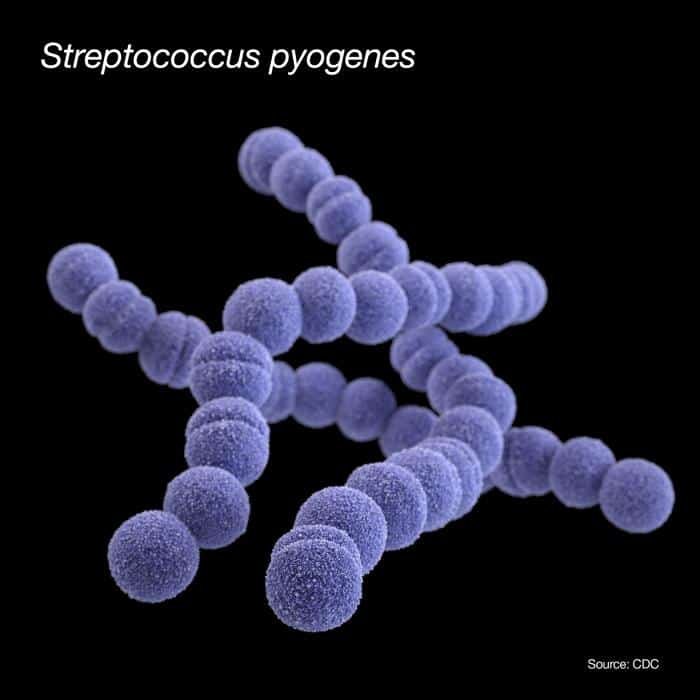
Se pueden dividir en 5 grupos y éstos en serotipos o grupos inmunológicos de Lancefield, desde la A-O, en base a la presencia de determinados antígenos específicos presentes en su pared.
Se denomina así porque la especie representativa es Streptococcus pyogenes. Se caracteriza porque incluye determinados patógenos capsulados, tanto del hombre como de otros animales. Presentan cápsulas (son virulentos). Contiene una proteína denominada M, o antígeno M, que son proyecciones pilosas de la pared celular que proporcionan resistencia y dificultan la fagocitosis. Además, la proteína M presenta su estructura antigénica similar a la de algunos antígenos propios. Cuando los anticuerpos reaccionan contra esa estructura no reconocen lo ajeno de lo propio, pudiendo desencadenar una reacción inflamatoria destructora.
Producen dos β-hemolisinas: hemolisinas ELO (=estreptolisina O que se inactiva en presencia de oxígeno) y ELS (=estreptolisina S que es estable en presencia de oxígeno). Afectan a los lípidos de la membrana de los eritrocitos. Son β-hemolíticos.
Producen leucocidinas por lo que son piógenos, además de producir hialuronidasa y fibrinolisina (una estreptoquinasa).
Pueden producir la enfermedad de la escarlatina, que produce un exantema característico que se inicia en la parte superior del tórax y se extiende por todo el cuerpo. Es una enfermedad grave, cuya sintomatología se debe a la toxina eritrogénica. Esta toxina no es producida por todas las cepas, sólo por aquellas que estás lisogenizadas por un fago atemperado. Es decir, está codificada por un bacteriófago. Esta toxina lesiona los vasos y produce vasodilatación y exantema.
Son bacterias típicas del tracto respiratorio y causan la mitad de los casos de anginas. Sin tratamiento antibiótico se pueden producir una serie de secuelas tardías: enfermedades post-estreptocócicas. Por ejemplo, la fiebre reumática, enfermedad autoinmune a causa de una faringoamigdalitis estreptocócica previa y recurrente, caracterizada por un elevado número de anticuerpos frente a los antígenos producidos por esta bacteria. Puede producir también glomerulonefritis aguda post-estreptocócica, también conocida como enfermedad de Bright, consecuencia de la formación de complejos antígeno-anticuerpo en los que en parte participa la proteína M, produce dolor, y pérdida de proteínas y sangre, entre otros síntomas. Ambas son enfermedades que, con un tratamiento adecuado en la infección inicial, se pueden evitar.
Las infecciones sistémicas fulminantes se caracterizan por una infección del tejido subcutáneo. Algunas bacterias producen exotoxinas pirógenas estreptocócicas (Spe) que causan muerte rápida: SpeA (superantígeno que estimula en linfocitos T la producción de gran cantidad de citoquinas, que dañan los vasos sanguíneos y sus células endoteliales provocando la pérdida de líquidos, falta de oxígeno en los tejidos) y SpeB (proteasa de cisteína). Su combinación conduce a una destrucción masiva de los tejidos y en un 30% de los casos la muerte. Hay patógenos de animales como el causante de mastitis de vacas.
Son α-hemolíticos pero no producen una auténtica lisis. Su hábitat es fundamentalmente la boca, la garganta y el tracto intestinal. Pertenecen a este grupo: S. mutans, S. salivarius y S. viridans. El primero, está relacionado con las caries dentales. Son conocidos como estreptococos orales.
S. faecalis o también llamados Enterococcus faecalis. Hay α-hemolíticos, β-hemolíticos y γ-hemolíticos. Son halotolerantes, aguantan hasta 6,5M; pero, a diferencia de los estafilococos, son anaeróbicos aerotolerantes y no mueren en presencia de azida sódica en condiciones aeróbicas.
Habitan en el tracto intestinal y pueden producir enfermedades en el tracto urinario. Algunos están presentes en ciertas plantas. Se pueden considerar indicadores de contaminación fecal que se determinan por las pruebas estreptométricas.
S. lactis también conocidos como Lactococcus lactis. No son patógenos ni tampoco hemolíticos. Se encuentran en plantas y derivados lácteos. Viven a bajas temperaturas (aprox. 10ºC). Son importantes en la industria láctica: Streptococcus lactis subespecie cremoris y Streptococcus thermofilus son muy comunes en la fabricación del yogur.
S. pneumoniae; también llamado Diplococcus pneumoniae. Son cocos en parejas y encapsulados (son virueltos). Son α-hemolíticos y producen una toxina denominada neumolisina, que destruyen las células del hospedador.
Pueden encontrarse como microbiota normal, pero algunos casos pueden producir una infección endógena que se contrae a partir de la propia microbiota. También puede causar meningitis neumocócica (para la cual hay vacuna)
Son bacilos no esporulados que pueden ser hetero u homofermentadores, y no pigmentadas. Son catalasa(-), oxidasa(-), peroxidasa(+). Forman colonias pequeñas y blancas que son fácilmente distinguibles si se pulverizan con carbonato cálcico, porque el ácido producido disuelve el carbonato cálcico formando lactato cálcico, translúcido.
Acido láctico + CaCO3 → Lactato cálcico + CO2 + H2O

Viven de forma óptima en condiciones de ligera acidez (pH 4'5-6'5). Es un género con alrededor de 100 especies diferentes. Se encuentra en la superficie de plantas, productos lácteos, carne, aguas residuales, frutas, bebidas, etc. También se encuentran formando parte de la microbiota normal del hombre en el tracto digestivo y tracto urinario.
Algunas especies de Lactobacillus son:
Son cocobacilos o bacilos cortos GRAM positivos (+) que forman cadenas de 3 a 5 células. Son psicrófilos y móviles a 25ºC; cuando se eleva la temperatura es inmóvil por inactivación de los flagelos perítricos. Está relacionada filogenéticamente con Lactobacillus. No es aerotolerante como los lactobacilos o estreptococos porque no crece en total ausencia de oxígeno y es catalasa (+), oxidasa (-), peroxidasa(-). Necesita condiciones microaerófilas o totalmente aerobias dependiendo de la especie. Al igual que las del ácido lácticas homofermentadoras, producen ácido láctico a partir de glucosa.
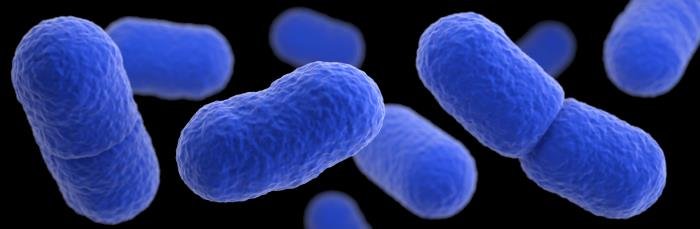
La especie más destacada es Listeria monocytogenes. Es patógena intracelular y β-hemolítica. Produce la enfermedad de la listeriosis que es una zoonosis que puede afectar al hombre. Cuando afecta al hombre es extremadamente grave, puede causar la muerte en el 20-30% de los casos. Se adquiere por ingestión de alimentos contaminados, donde forman biopelículas sobre leche cruda, carnes crudas o alimentos mal cocinados.
Su periodo de incubación es muy largo por eso los síntomas aparecen tarde, lo que dificulta el rastreo del alimento que provocó el problema. Puede manifestar síntomas muy diversos como meningitis, fiebres tifoideas, gripe, pneumonía, incluso septicemia. Un problema aún más grave es cuando infecta a mujeres embarazadas porque ocasiona daños en el feto como la granulomatosis infactoséptica o incluso la muerte (abortos en el 30% de los casos). Para evitarla, se aconseja no consumir alimentos crudos o poco cocidos.
Es una bacteria psicrófila, vive a temperaturas de refrigeración. Emplea como factores de virulencia: fosfolipasas (rompen fosofolípidos), una proteína activadora de la actina y una toxina llamada listerolisina O (toxina LLO) que es una β-hemolisina. Esta LLO es una citotoxina hemolítica que se fija al colesterol y rompe células. Las hemolisnas se secretan a pH ácido y en baja concentración de hierro, condiciones presentes en el interior de los fagosomas.
Entra en la célula por fagocitosis inducida o endocitosis. Una vez dentro se adhiere a unos receptores de D-galactosa y se forma un fagosoma (vacuola). Una vez formada la vacuola la va a lisar por la listerolisina y una vez libre en el citoplasma se divide por fisión binaria y se desplaza por el citoplasma mediante colas de actina. Es un mecanismo de movilidad muy interesante: secuestra algunos componentes celulares mediante la polimerización de la actina. También facilita el paso a otras células, formando una protusión impulsada por las colas de actina, y pasa a otras células sin necesidad de ponerse en contact con el exterior. De este modo evita ser atacada por las defensas humorales, pues no entra en contacto con el medio externo, sólo puede ser destruida por inmunidad celular.
Son quimioheterótrofos y se caracterizan por presentar un estado de vida latente o criptobiosis, mediante la formación de endosporas. Son GRAM positivos (+). Desde el punto de vista filogenético, los distintos géneros no están relacionadas ya que la proporción del contenido G+C es variado entre todas las especies. Desde el punto de vista ecológico sí están relacionadas: en la naturaleza, la mayoría se encuentran en el suelo. Pueden permanecer largo tiempo en forma de espora y germinar después.
Hay importantes patógenos que son saprófitos del suelo y solo infectan al hombre de forma fortuita, por la producción de exotoxinas; por lo que normalmente no necesitan invadir al hospedador. Permanece en el foco de infección y las toxinas producen los daños. Aunque en ocasiones sí invaden como es el caso de Bacillus anthracis que invade el torrente sanguíneo del hospedador ocasionando bacteriemia.
La esporulación puede ir acompañada con la síntesis de sustancias de tipo antibiótico, que son péptidos de alto peso molecular cuya función no se conoce exactamente. Para las bacterias productoras son metabolitos secundarios que quizá favorezcan que la esporulación sea la adecuada.
Se pueden aislar seleccionándolas a partir de un suelo u otros materiales, calentado la muestra 10 min a 80ºC. De este modo se activa la germinación de las endosporas, las mantiene viables y elimina las células vegetativas. Una vez calentadas, sembramos la muestra en un medio adecuado y así podremos aislar colonias.
Si lo incubamos aeróbicamente crecerán los del género Bacillus, y si es anaeróbicamente crecerán los Clostridium.
Son bacilos quimioheterótrofos, normalmente móviles por la aparición de flagelos peritricos. Muchos producen antibióticos (bacitrana, polimixinas, gramicidina). Son catalasa (+).
Son catalasa (+), GRAM(+), móviles por la presencia de flagelos perítricos. Los antibióticos los producen durante la esporulación, cuando entran en fase estacionaria, y el proceso ya es irreversible.

El cristal paraesporal se convierte en forma activa en contacto con el contenido alcalino del intestino de la larva de insecto. Entonces se fragmenta y se liberan exotoxinas de 250Kda, que se activan gracias a una proteasa del intestino y se convierte en una forma activa de 68KDa. Esta forma activa es la que produce daños en la larva, ya que se une a células epiteliales del intestino y provocan la pérdida del contenido celular, provocan la lisis de la célula. El animal muere por inanición (todos los nutrientes ingeridos se pierden).
Se han secuenciado los genes de esta proteína paraesporal, que presentes en un plásmido. Las proteínas se denominan toxinas BT, y por ingeniería genética se han hecho modificaciones. Así, se han podido introducir estos genes en plantas y se han hecho resistentes a insectos de un modo "natural".
También se emplea a nivel de pulverización sobre plantas (como biopesticidas), a nivel de esporas o proteínas paraesporales. Tiene interés para el control ecológico de plantas, ya que se puede dirigir sobre qué insectos se quiere actuar, intentado reducir el uso de insecticidas y pesticidas químicos.
Es una reclasificación de los Bacillus que se ha separado. Estos son anaerobios facultativos, fermentadores de azúcares y productores de ácido, y a veces, gas. Son móviles y con endosporas elipsoidales y paredes gruesas.
La especie más destacada de Paenibacillus es:
Viven en ambientes anaerobios, pero en forma vegetativa. Son catalasa (-) y oxidasa (-). En forma de endospora puede estar en presencia de oxígeno. Uno de los géneros es Desulfotomaculum, una bacteria sulfatorreductora, GRAM(+) y endosporulada. Puede estropear alimentos en conserva mal procesados. Su presencia se puede detectar por el olor a huevos podridos del sulfhídrico desprendido de Desulfotomaculum.
Clostridium es el género representativo, con forma de bacilo. Es catalasa (-) o debílmente positivo, y oxidasa (-). Nunca respira, siempre fermenta. Contiene más de 100 especies con características metabólicas dispares en ocasiones. No tienen CTE y obtienen ATP por fosforilación a nivel de sustrato.
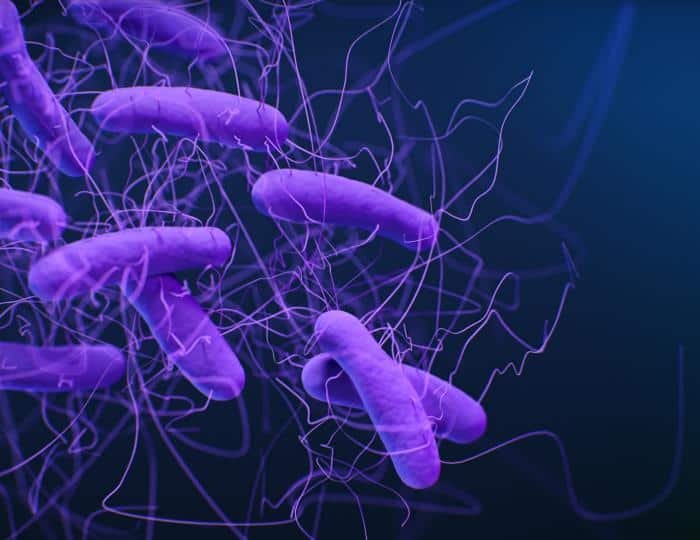
Tienen una variada capacidad fermentativa y dependiendo del producto de fermentación se clasifican en 5 subgrupos.
Fermentan azúcares que producen butirato, como C. lactoacetophillum, aunque carece de la denominada fermentación de la acetona-butanol.
El butanol y otros compuestos se producen en la mayoría de los casos de los clostridios con fermentación acetobutírica (fermentación de la acetona-butanol). Esta tuvo relevancia industrial como la principal fuente industrial de acetona y butanol, aunque hoy en día la ha reemplazado la síntesis química, ya que resulta mucho más rentable. Una de las especies que la realiza es C. pasteurianum, el mayor responsable del nitrógeno fijado en anaerobiosis en el suelo; aunque no el único, pues la fijación de N2 es muy frecuente entre las bacterias del género Clostridium.
Otras en cambio no producen butirato, como C. cellobioparum, que usa celulosa y produce alcoholes y mezclas de ácidos orgánicos. Este microorganismo y otros de este tipo son el principal grupo de microorganismos degradadores anaeróbicos de la celulosa en el suelo. Existe gran interés en el estudio de este tipo de microorganismos para la producción de etanol como aditivo para combustibles de automóviles; se trata de aumentar la cantidad de etanol producido respecto a ácidos orgánicos. C. aceticum usa la glucosa y produce acético, es homoacetogénica. Se ha visto que en el acetato producido, aproximadamente 2/3 de los C proceden de la glucosa pero el 1/3 restante procede de CO2, pues usa la vía del acetil-CoA.
Pueden fermentar aminoácidos; algunos de ellos provienen de proteínas, otros no. Algunos llevan a cabo la putrefacción (descomposición microbiana de materia orgánica) que produce compuestos de olor desagradable como aminas, amoníaco, sulfhídrico, etc. Muchos clostridios son proteolíticos porque producen gran cantidad de proteasas, aunque no todos los que fermentan aminoácidos son proteolíticos.
Los no proteolíticos pueden crecer en presencia de aminoácidos libres. Éstos fermentan los aminoácidos por la reacción de Stickland (fermentación de pares de aminoácidos), donde un aminoácido actúa como donador de electrones y otro como receptor. Un ejemplo es C. botulinum, que fermenta pares de aminoácidos.
Algunos solo fermentan aminoácidos de forma individual como C. tetani y C. histolyticum.
Fermentan aminoácidos y azúcares: si fermenta azúcares lo hacen hasta butirato, y cuando se agotan o simplemente no hay, emplean aminoácidos. Depende de la disponibilidad de cada uno de ellos en el medio.
Con uno o más nitrógenos: bases nitrogenadas, ácido nicotínico, etc.
Fermenta etanol a ácidos grasos como es el caso de C.kluyveri. Puede producir butirato pero fermentando alcoholes como el metanol. Emplea una mezcla de etanol y acetato, uno actúa como donador y el otro como receptor.
El hábitat principal de los clostridios es el suelo aunque algunos también habitan el tracto intestinal de mamíferos ocasionando graves enfermedades siendo patógenas.
Los patógenos son:
Engloba a los micoplasmas, procariotas inusuales porque carecen de pared celular. Son los más pequeños de crecimiento autónomo. Su tamaño oscila entre 0.3 y 0.8 micras. También se han identificado elementos de menos tamaño (0.1 micra), pero son inviables.
Tienen interés evolutivo adicional por su estructura sencilla y tamaño genómico reducido, del orden de la mitad o menos del tamaño del genoma de una bacteria normal de unos 500 a 1500K pares de bases. El contenido está muy cercano a lo mínimo para especificar propiedades de organismo celular, aunque se han encontrado genomas más pequeños, pero de endosimbiontes. Se han secuenciado algunos genomas de micoplasmas patógenos humanos y otros, y contienen menos de 1000 genes. Por tanto, se necesitan pocos genes para mantener una vida independiente.
No se tiñen, pero están emparentados filogenéticamente con las GRAM (+), tanto esporulantes como no esporulantes. Se cree que antes poseían pared, pero dejaron de usarla debido a los hábitats especiales donde se suelen encontrar. Si carecen de pared le proporciona características beneficiosas ya que presentan una elasticidad celular que les permite pasar a través de filtros de membrana. Por esto, los cultivos de tejidos animales no se esterifican por filtración, sino que se les añade antibióticos para impedir el crecimiento de micoplasmas contaminantes. Son muy deformables, fáciles de dañar y pleomórficos. Cuando las condiciones no son adecuadas se transforma en célula filamentosa, pero cuando vuelven a recuperarse las condiciones adecuadas se dividen por fisión múltiple.
También son resistentes a antibióticos que inhiben la síntesis de pared celular. Esta característica se aprovecha para aislarlos de muestras naturales.
Para mantener la turgencia, contienen esteroles en su membrana que les proporciona cierta rigidez. En otros casos pueden presentar pigmentos de tipo carotenoide (que dan estabilidad). En todos los casos, mantienen el citoplasma a la misma presión que el medio exterior bombeando activamente sodio fuera de la célula. De hecho, si se bloquea ese bombeo o si se le priva de una fuente de energía, provoca el hinchamiento y la lisis celular casi instantáneamente.
Muchos tienen lipoglicanos, heteropolisacáridos de cadena larga unidos covalentemente a los lípidos de la membrana, aunque no están en todos. Estos lipoglicanos que no tienen nada que ver con los lipopolisacáridos de GRAM negativos (-), aunque se parecen en cierto modo estructuralmente. Los lipoglicanos que están presentes en micoplasmas, tanto si requieren o no esteroles en el medio, están implicados en estabilizar la membrana plasmática y facilitar la adherencia de los receptores de las células animales. También tienen características antigénicas. Se dividen por fisión binaria o múltiple, son móviles, aunque sin flagelos, se deslizan en superficies cubiertas de líquido, y los que son helicoidales sí pueden girar y flexionarse.
Las colonias en medio sólido suelen ser pequeñas, de aproximadamente medio milímetro, en algunos casos observables al microscopio, y tienen forma de huevo frito. Tienen una zona central más elevada, casi esférica incrustada en el sustrato (agar) y alrededor hay una fina película translucida de crecimiento superficial.
La mayoría son anaerobios facultativos, quimioheterótrofos y la mayoría fermentan. Las que fermentan realizan una fermentación parecida a la de las bacterias ácido lácticas, por lo que producen ácido láctico. Hay una excepción, la Ureaplasma, que siempre respira, nunca fermenta.
Son estrictamente exigentes con los nutrientes. Algunas necesitan esteroles necesariamente excepto el género Acholeplasma que no necesita esteroles para crecer, aunque sí puede incorporarlo. Crecen en medios complejos in vitro proporcionándoles los factores de crecimiento necesarios. Algunos son parásitos comensales, saprófitos, incluso muchos son patógenos del hombre, animales y plantas.
Patógeno de mamíferos o de aves, requiere colesterol en la membrana. Tiene lipoglicanos. Hay más de 100 especies.
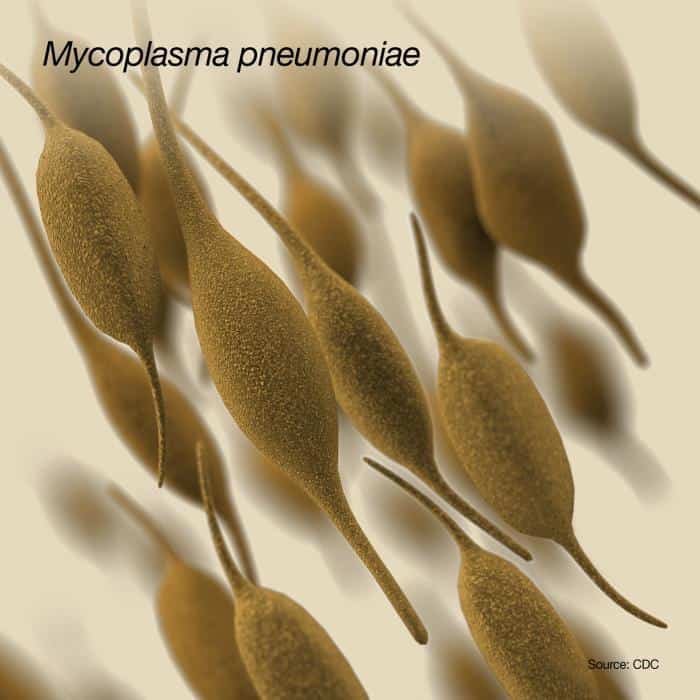
Requiere colesterol, pero no presenta lipoglicanos en la membrana. Tiene una morfología helicoidal que sí es móvil, gira y se flexiona, pero no presenta flagelos ni filamentos axiales; el movimiento es debido a fibrillas intracelulares que se contraen. Al igual que las espiroquetas se mueven mejor en medios viscosos.

Se pueden encontrar en artrópodos y plantas, también en vertebrados como roedores, aves, etc. Son frecuentes en las glándulas salivares, hemolinfa e intestino artrópodos que se alimentan de plantas. Hay muchas especies, aunque no tantas como Mycoplasma: unas 20 aproximadamente. Las hay asociadas a diversas condiciones patógenas en plantas como rábanos, judías, maíz, etc. Es posible que se transmitan de planta a planta por vectores como artrópodos, aunque también causan enfermedades en los mismos artrópodos.
S.citri causa ciertas enfermedades en cítricos. Algunas especies son patógenas de insectos, roedores, pollos,etc. Pueden causar espiroplasmosis de abeja melífera, cataratas de ratón lactante, etc.
La microbiología esta indudablemente unida al progreso de los microscopios. De hecho, la historia de la microbiología como ciencia comienza con la creación de microscopios. Para observar mejor a los microorganismos se han desarrollado colorantes, tinciones diferentes que se usarán en función de nuestro objetivo.
Un microscopio es un conjunto de lentes que concentran y enfocan la luz sobre una muestra para formar imágenes visuales. El concepto de microscopio se basa en una propiedad física de la luz: la difracción. Cuando un rayo de luz pasa por dos superficies distintas, que produce una desviación que produce un retraso en la velocidad conocido como índice de refracción, producido entre dos medios cuando la luz pasa a través de ellos.
LR = λ / (2n * sen θ)
Con los microscopios normales no se puede observar a menos de 100nm; el objetivo máximo en un microscopio óptico es 100x (solo usando el aceite de inmersión, sino 50x).

En la siguiente tabla se pueden ver las diferencias entre el microscopio óptico y el microscopio electrónico.
| MO | ME | |
| Aumento | 1.000-1.500 | > 100.000 |
| Resolución máxima | 0,2 µm | 0,5 nm |
| Fuente de radiación | Luz visible | Haces de electrones |
| Lentes | Lentes de vidrio | Lentes electromagnéticas colocadas simétricamente respecto al eje axial que enfocan el haz de electrones, a través de un tubo en el que se ha hecho vacío, sobre la muestra. |
| Fuente de contraste | Absorción de luz diferencial | Dispersión de electrones |
| Medio de desplazamiento | Aire | Alto vacío |
| Montaje de la muestra | Portaobjetos | Rejillas metálicas Tratamiento previo de las muestras |
Basicamente, se pueden observar a los microbios mediante 2 tipos de preparaciones:
Para mejorar el contraste entre los microorganismos y el medio lo que hlacemos es recurrir a las tinciones, tratando las muestras celulares mediante colorantes que son sustancias con una afinidad especial por determinados componentes o estructuras celulares. Como resultado de la tinción lo que vamos a observar son muuestras de microorganismos teñidas más contrastadas sobre un medio difuso (no teñido). En microbiología vamos a utilizar siempre preparaciones fijadas, es decir, muestras de células muertas, y para las tinciones se utilizan colorantes (no tintes).c
Todo colorante lleva dos partes:
Los colorantes se van a clasificar en función del grupo auxocromo:
Comprende varias partes:
Fundamentalmente hay dos:
En el artículo que enlazamos a continuación podrás ver las tinciones y colorantes principales usados en microbiología.
Data del año 1884, por Hans Christian Gram. La preparación consta de varias partes:
Es preferible utilizar cultivos jóvenes, para evitar alteraciones en la pared y por lo tanto, confusiones. Si se abusa del alcohol se puede extraer la tinción de las GRAM+ por lo que hay que tener cuidado.
Para ver la tinción de Gram con más detalle tienes el siguiente artículo donde se analiza la tinción de Gram además de otras tinciones y colorantes usados en microbiología.
¿Alguna vez te has preguntado cómo las bacterias logran mantener su forma y protegerse a sí mismas contra factores externos? La respuesta está en el peptidoglicano, una molécula clave en la estructura de la pared celular de las bacterias.
Este material es tan importante para ellas, que sin él simplemente se desintegrarían. ¿Quieres saber más sobre cómo el peptidoglicano juega un papel crucial en la biología bacteriana? ¡Sigue leyendo para descubrirlo!
El peptidoglicano es un compuesto exclusivo de bacterias, formado por azúcares y aminoácidos, de ahí su nombre (péptido, uno o más aminoácidos unidos mediante enlaces químicos; glicano, polímero de monosacáridos, o, en otras palabras, conjunto de azúcares simples). No es una proteína.
Es el compuesto cuya función es dar rigidez, consistencia y forma a la pared celular bacteriana. De hecho, si se inhibe su biosíntesis o su degradación especifica durante el crecimiento celular esto acaba provocando la lisis celular; de ahí que muchos antibióticos ataquen estos procesos.
La pared celular es un elemento de suma importancia en la bacteria, ya que resiste la gran presión osmótica interna de la célula, y el peptidoglicano es el elemento clave para sus características. La composición química de esta compuesto es bastante similar en GRAM+ y GRAM-, aunque tienen diferencias que veremos más adelante. De hecho, esas diferencias son las que dividen a las bacterias en estos dos grupos: bacterias gram positivas y gram negativas. El peptidoglicano también se conoce como peptidoglucano o mureína. Es un compuesto que aparece exclusivamente en bacterias; no aparece en organismos eucariotas.
La cubierta de peptidoglicano envuelve a la célula bacteriana, y se encuentra por encima de la membrana celular, pero debajo de la membrana externa en las bacterias que tengan esta estructura (bacterias GRAM negativas).
El peptidoglicano está formado por una secuencia alternante de dos azúcares, N-acetil-glucosamina (NAG) y el ácido N-acetilmurámico (NAM), unidos por enlaces β(1→4), entre el C1 de NAM y el C4 de NAG*. NAM es un derivado de NAG al que se le ha añadido una molécula de ácido láctico en el C3. La estructura del peptidoglicano está conformada por tres capas que veremos a continuación.
*En el caso de las arqueas, su pared celular tiene pseudopeptidoglucano formado por N-acetil-glucosamina unida a N-acetiltalosaminomurámico mediante enlaces β(1→3).
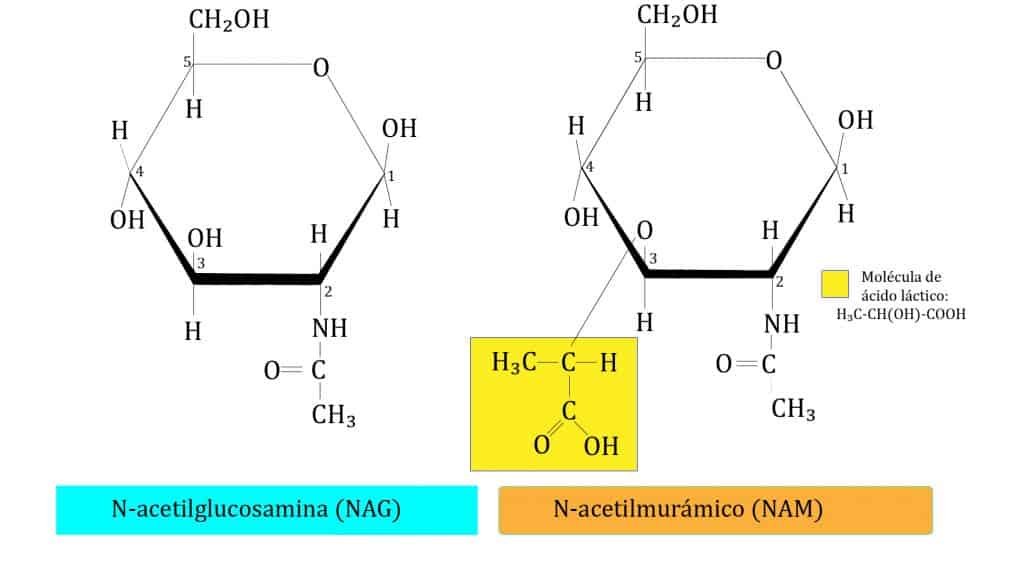
La primera capa del peptidoglicano (horizontal) está formada por filas lineales de NAG y NAM unidos de forma secuencial, mediante enlaces covalentes.
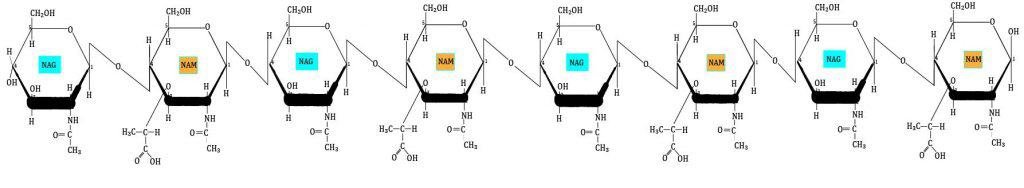
La segunda capa (vertical) está formada por un tetrapéptido unido solamente a NAM (esta es otra diferencia entre NAG y NAM). A este tetrapéptido se le denomina tetrapéptido del glicano. Este tetrapéptido contiene:
La formulación de estos aminoácidos unidos a NAM se encuentran en la imagen de abajo.
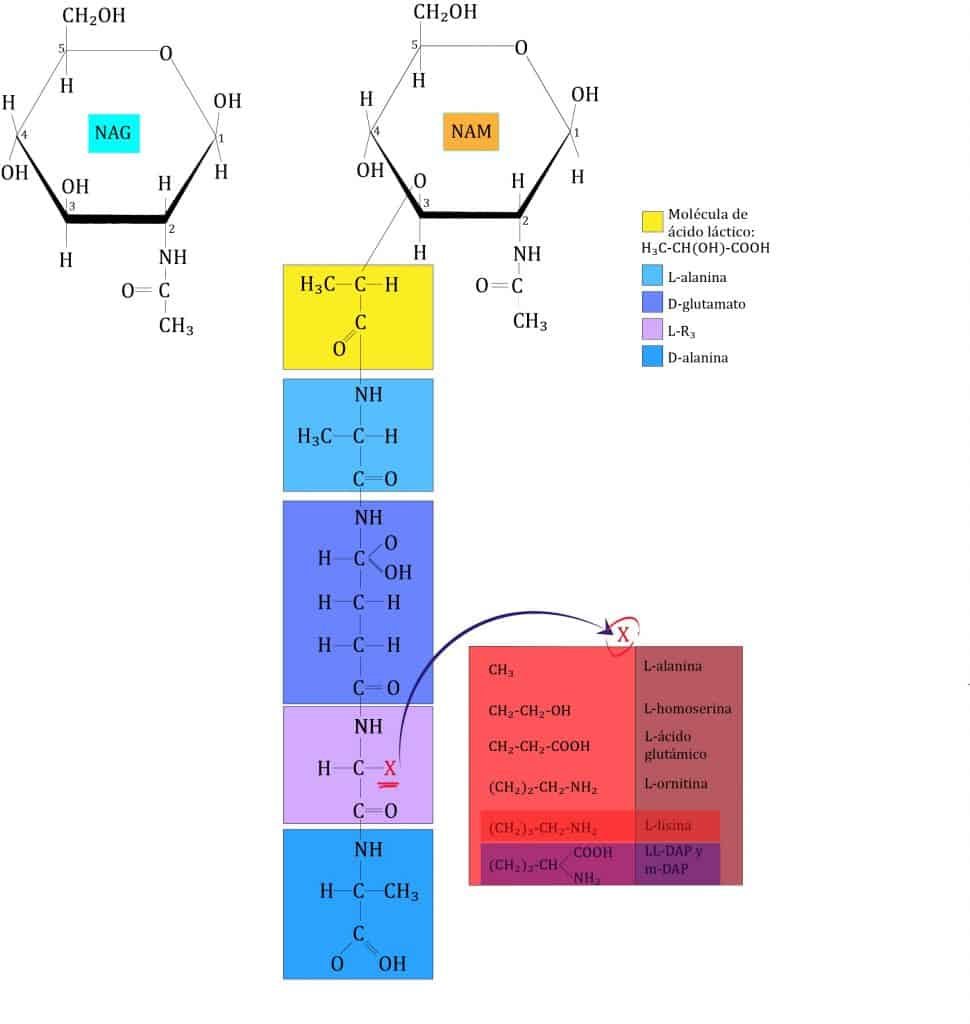
Como se puede ver, aquí aparecen proteínas formadas tanto de d-aminoácidos como de l-aminoácidos, de ahí una de sus particularidades (ya que las células usan solo l-aminoácidos para formar proteínas).
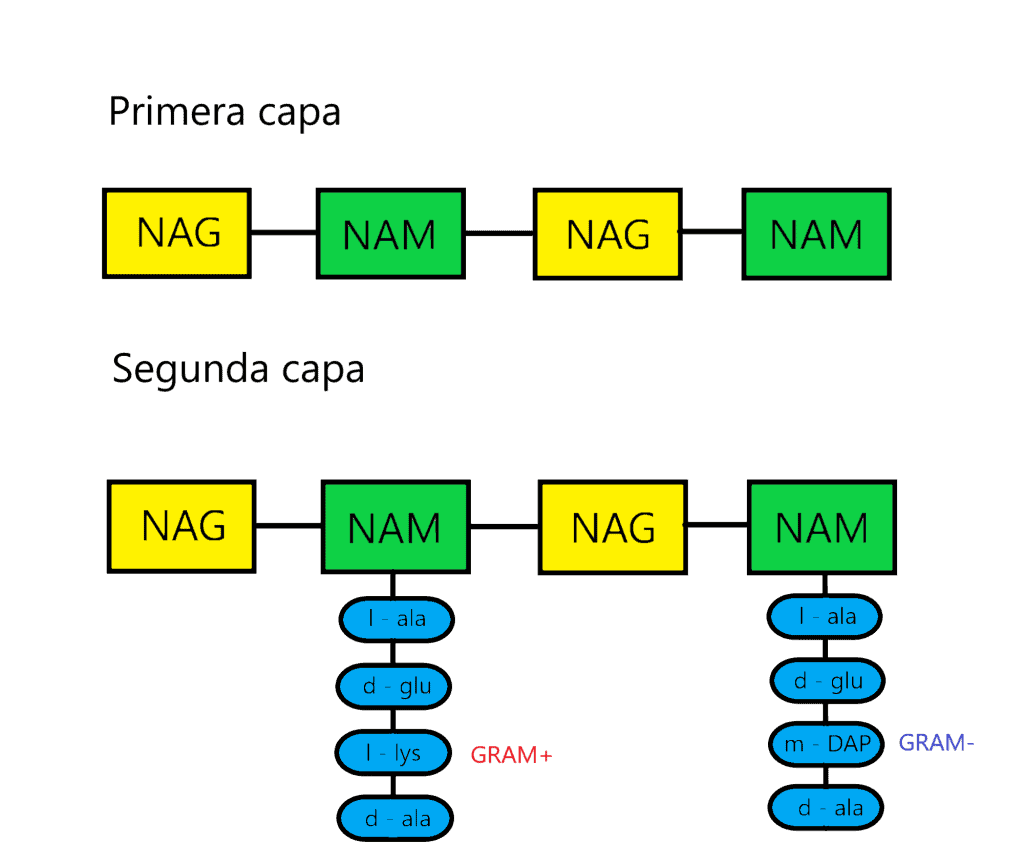
La tercera capa está formada por la unión de dos NAM vecinos. Para ello, la mayoria de veces se forma un enlace peptídico entre el cuarto aminoácido de un tetrapéptido (d-alanina) y el tercero de otro (L-lisina o m-DAP) mediante una reacción de transpeptidación. La composición de estos puentes peptídicos varía entre los diferentes grupos bacterianos; de hecho, los aminoácidos y la posición de este enlace se ha usado para clasificarlos (taxonomía). En bacterias GRAM- y algunas especies de Bacillus el enlace es directo, entre la D-alanina y el ácido diaminopimélico (m-DAP). En la mayoría de bacterias GRAM+ hay un puente formado por uno o más aminoácidos. Ejemplos:
A veces el puente es desde el aminoácido D-alanina terminal hasta el α-carboxilo de ácido D-glutámico del otro tetrapéptido. Debido a que hay una conexión entre 2 grupos carboxilo, es necesario que el puente contenga diaminoácidos.
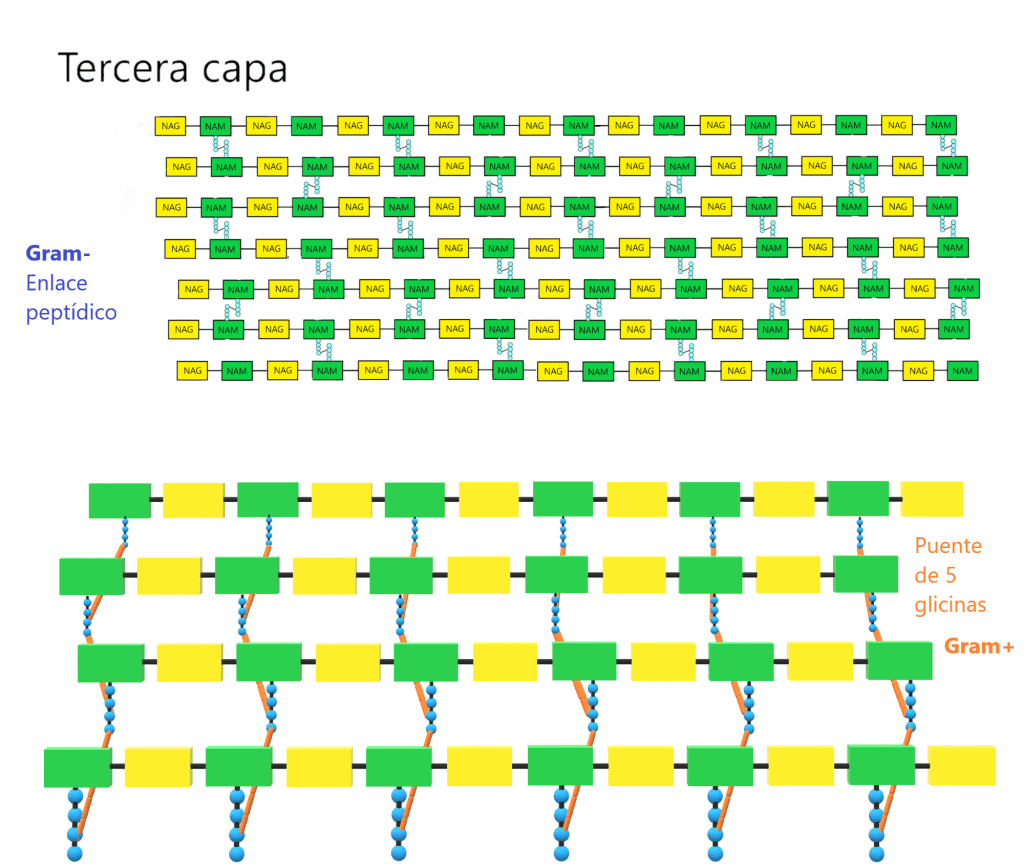
Estas tres capas forman la estructura tridimensional que da rigidez a la pared. Aunque pueden haber variaciones en la parte proteica del peptidoglicano, los enlaces entre NAG y NAM iguales para todas las especies bacterianas. No todos los tetrapéptidos unidos a NAM sufren la reacción de transpeptidación. De hecho, la pared tiene que tener algo de porosidad para permitir el paso de sustancias por la pared. Además, para que la célula pueda replicarse, necesita dividirse, expandirise, y es otra razón por la que la pared debe tener cierta flexibilidad. Ahora bien, cuantos más tetrapéptidos sufren la reacción de transpeptidación, más resistente será la pared celular.
La síntesis del nuevo peptidoglicano ocurre durante el proceso de crecimiento celular. Hay cuatro fases en este proceso. Primero, se forman los precursores del PG, que son derivados UDP de aminoazúcares formados en el citosol. Después, los aminoazúcares se transfieren a un transportador lipídico de membrana que los lleva a los aminoazúcares a través de la membrana celular. Más adelante, el PG se formará en la superficie externa de la membrana. Por último, ocurrirá la reacción de transpeptidación que forma puentes entre tetrapéptidos de NAM.
Los azúcares NAG y NAM son los precursores del PG. Ambos se forman a partir de la fructosa-6-fosfato. Las reacciones se pueden ver en la imagen de abajo. Todo empieza cuando la glutamina da un grupo amino a la fructosa-6-fosfato, que la convierte en glucosamina-6-fosfato (1) Esta reacción esta mediada por la enzima fructosa-6-fosfato aminotransferasa. Más tarde, una transacetilasa (glucosamina fosfato transacetilasa) transfiere un grupo acetilo que proviene del acetil-CoA al grupo amino de la glucosamina-6-fosfato, y forma la N-acetilglucosamina-6-fosfato (2). La N-acetilglucosamina-6-fosfato sufrirá un proceso de isomerización, mediada por la N-acetilglucosamina fosfomutasa que la transformará en N-acetilglucosamina-1-fosfato (3). Este monofosfato ataca a UTP, y desplaza el pirofosfato, cambiando el compuesto a UDP-N-acetilglucosamina (UDP-GlcNAc); reacción en la que interviene la enzima UDP-N-acetilglucosamina fosforilasa (4). A partir de aquí, algunos de los UDP-GlcNAc se usan como precursores de la N-acetilglucosamina, mientras que otros se convierten en ácido UDP-N-acetilmurámico (UDP-MurNAc).
UDP-GlcNAc se covierte en UDP-MurNAc añadiendo un grupo lactilo (5). Durante está reacción, mediada por la enolpiruvato transferasa, el grupo hidroxilo C₃ desplaza un fosfato del carbono α del fosfoenolpiruvato, formando el UDP-N-acetilglucosamina-3-enolpiruvatoéter. Después, el derivado de enol se reduce a una porción de lactilo mediante el NADPH, en una reacción llevada a cabo por la enzima UDP-N-acetilglucosamincenol-piruvato reductasa (6). UDP-MurNAc se acaba convirtiendo en pentapéptido UDP-MurNAc mediante la adición secuenciada de (7):
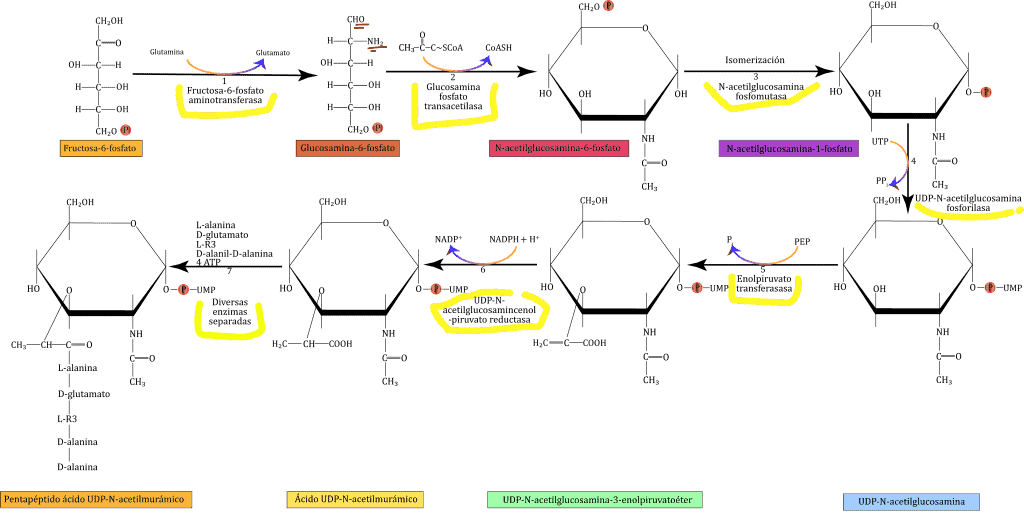
Cada reacción es catalizada por enzimas específicas y requiere ATP para activar el grupo carboxilo del aminoácido. El grupo carboxilo es un acil fosfato, que es atacado por el grupo amino que viene a unirse al aminoácido, desplazando el fosfato. Esta reacción produce ADP y un fosfato inorgánico. El dipéptido D-alanil-D-alanina se forma por la actuación de dos enzimas: la L-alanina-racemasa, que convierte L-alanina en D-alanina; y la D-alanil-D-alanil sintetasa dependiente de ATP, que forma D-alanil-D-alanina a partir de 2 D-alaninas. La quinta D-alanina se extraerá de esta estructura en el proceso de transpeptidación que veremos más adelante. Ambas enzimas, la racemasa y la sintetasa, son inhibidas por el antibiotico D-cicloserina.
Este pentapéptido UDP-MurNAc se transfiere al transportador lipídico en la membrana, y empiezan así los procesos en la membrana celular.
El transportador lipídico que al que nos referimos es el bactoprenol (o undecaprenil-fosfato), un isoprenoide fosfato C55 hidrófobo. Además de transportar los precursores del PG, también mueve los precursores de otros polímeros, como el lipopolisacárido (LPS) o los ácidos teicoicos. Los nucleótidos azucarados se mueven por difusión a la superficie citoplasmática de la membrana, y allí el bactoprenol (lípido-P) ataca al pentapéptido UDP-MurNAc, liberando UMP (1). El producto es el pentapéptido lípido-PP-MurNac. GlcNAc se transfiere del UDP-GlcNAc a MurNAc en el transportador lipídico cuando el C4 hidroxilo en MurNAc ataca el carbono C1 en UDP-GlcNAc, liberando UDP (2). El compuesto resultante es el disacárido precursor del PG, pentapéptido lipido-PP-MurNAc-GlcNAc. Este compuesto se moverá al otro lado de la membrana (3). Si bien no se sabe exactamente como se mueve a través de la membrana, parece ser que es ayudado por proteínas aun por identificar.
Las proteínas fijadoras de penicilina (PBP), o autolisinas, estarán envueltas en los procesos de transglicosilación, transpeptidación y carboxipeptidación. En el lado externo de la membrana, este compuesto es transferido al glicano en formación y se sitúa en la parte final de la cadena. Esta reacción es una transglicosilación en la cual el C4 hidroxilo de GlcNAc en formación ataca el C1 de MurNAc del glicano, desplazando el bactoprenol de la cadena de glicano que se está formando (4,5). Esta reacción es catalizada por una enzima transglicosilasa ligada a la membrana (PBP-1a y PBP-1b).
No obstante, la cadena de glicano en formación sigue anclada a la membrana por el carrier lipídico en el sitio de la transglicosilasa. El lípido-PP formado por la cadena en formación se hidroliza por una pirofosfatasa ligada a la membrana, que forma lípido-P y libera un fosfato (6). Esta reacción es de suma importancia, ya que finaliza la reacción de transglicosilación, debido a que la hidrólisis del fosfodiester libera energía (el fosfato). Además, así se vuelve a formar el lípido-P (bactoprenol) que se puede reutilizar para la formación de PG u otros polímeros (7). Esta hidrólisis es inhibida por el antibiótico bacitracina.

El proceso de síntesis de peptidoglicano debe estar perfectamente coordinado. Los nuevos tetrapéptidos se deben unir al PG existente justo después de que las autolisinas actúen. Sino, se formaría una brecha en la integridad del PG en el punto de empalme, que podría desembocar en la lisis espontánea de la bacteria (autolisis).
Para formar los puentes peptídicos entre los tetrapéptidos de NAM de cadenas adyacentes y así unir a los péptidos (cross-linking) hace falta energía. La transpeptidación es el proceso por el cual se obtiene energía necesaria para unir a los péptidos. En el peptidoglicano maduro, un grupo NH₂ del diaminoácido de la tercera posición (por ejemplo, el diamino-pimélico) ataca el carbonilo (C=O), desplazando el aminoácido D-alanina terminal (hidrolización). Este proceso está mediado por transpeptidasas (PBP-1a y PBP-1b). Los residuos D-alanina terminales que no participan en estas uniones también se eliminan, pero este proceso lo lleva a cabo la carboxipeptidasa D-alanina (PBP-4, PBP-5 y PBP-6). Diversos antibióticos, como la penicilina, inhiben esta reacción.
Como ya hemos comentado, la pared celular tiene muchas funciones, y una de ellas es resistir la presión osmótica interna de la bacteria. El peptidoglicano es de suma importancia para que la pared celular tenga las propiedades que necesita la bacteria. De hecho, si se inhibe la biosíntesis del peptidoglicano o su degradación especifica durante el crecimiento celular esto acabará desembocando en la lisis de la célula (destrucción de la célula). Por ese motivo, usamos diversos antibióticos que atacan dichos procesos. Veamos varios antibióticos que se usan para el tratamiento antimicrobiano:
El peptidoglicano, si bien es un compuesto común de las bacterias, tiene diferencias entre organismos GRAM+ y GRAM-, como los que veremos a continuación (en la tabla final se puede ver un resumen de estas).
En bacterias GRAM+, el peptidoglicano ocupa hasta el 90% de la pared celular. Pueden aparecer bacterias con solo una capa de peptidoglicano rodeando a la célula, pero la mayoría de bacterias cuenta con muchas láminas apiladas unas sobre otras. Eso sí, la capa se sitúa en el exterior de la membrana plasmática. En la tinción de Gram, dentro de las células se forma un complejo cristal violeta-yodo que NO puede extraerse. Y es debido a sus gruesa pared celular formada por varias capas de peptidoglicano. Al introducir alcohol, se deshidratan, lo que provoca el cierre de los poros de las paredes, así que el colorante no sale de la bacteria. Además, en bacterias GRAM+ aparecen los llamados ácidos teicoicos. Son polímeros de la pared que contienen unidades de glicerolfosfato o de ribitolfosfato. También pueden tener unidos otros azúcares y d-alanina. Los ácidos teicoicos se unen mediante enlace covalente a residuos de NAM. Pueden intervenir uniendo calcio (Ca2+) y magnesio (Mg2+) para su transporte. Tienen carga negativa, así que tienen su parte de responsabilidad de la carga negativa de la superficie celular.
En bacterias GRAM-, el peptidoglicano ocupa hasta el 10% de la pared celular. Está situada entre la membrana externa y la membrana interna de la célula. La mayor parte de la pared celular está formada por la membrana externa, una segunda bicapa lipídica que, aparte de fosfolípidos y proteínas, también contiene polisacáridos. A esta membrana se le llama lipopolisacárido (LPS). En la tinción de Gram, dentro de las células se forma un complejo cristal violeta-yodo que puede extraerse. Y es debido a que la membrana externa es rica en lípidos, además de que la capa de peptidoglicano es tan fina que no impide el paso del solvente, así que el colorante sale de la célula. Después del tratamiento con alcohol, estas bacterias reciben una tinción de contraste, la safranina, para diferenciarse de las bacterias GRAM+.
| Diferencias entre bacterias GRAM+ y GRAM- | ||
|---|---|---|
| Bacterias | GRAM+ | GRAM- |
| Tamaño de PG | Hasta 90% de la pared celular | Hasta el 10% de la pared celular |
| Localización del PG | Al exterior de la membrana plasmática | Entre la mebrana interna y la membrana externa |
| Tinción de GRAM | Complejo cristal violeta-yodo | Safranina |
| Color en la tinción de GRAM | Azul, violeta | Rojo, rosa, naranja |
| Tercer aminoácido del tetrapéptido | L-lisina normalmente; mucha variación de aminoácidos | m-DAP casi siempre; poca variación de aminoácidos |
| Transpeptidación (cross-linking) | Casi siempre puente de aminoácidos | Casi siempre enlace directo |
| Compuestos unidos a PG | Ácidos teicoicos | Lipopolisacárido (LPS) |
Calvo. J, Martínez-Martínez. L, Mecanismos de acción de los antimicrobianos. (2009) Enfermedades Infecciosas y Microbiología Clínica, Volume 27, Issue 1, Pages 44-52, ISSN 0213-005X. DOI: 10.1016/j.eimc.2008.11.001.
Mensa. J, Gatel. J. M, García-Sanchez. J. E, Letang. E, López-Suñe. E, Marco. F. (2018) Guia de terapeútica antimicrobiana 2018, Editorial: Antares, Nº de edición: 28ª, ISBN-13: 9788488825247
Michael T. Madigan. (2015) Brock: biología de los microorganismos. Edición 14. Pearson Educación. ISBN: 8490352798, 9788490352793
Vollmer, W., & Höltje, J. V. (2000). A simple screen for murein transglycosylase inhibitors. Antimicrobial agents and chemotherapy, 44(5), 1181–1185. https://doi.org/10.1128/aac.44.5.1181-1185.2000
Vollmer W, Blanot D, de Pedro MA. (2008) Peptidoglycan structure and architecture. FEMS Microbiol Rev. 2008;32(2):149‐167. doi:10.1111/j.1574-6976.2007.00094.x
White, D., Drummond, J., & Fuqua, C. (2012). The physiology and biochemistry of prokaryotes. New York: Oxford University Press.

Microbiología© (2023). Todos los derechos reservados