- Microbiología
- Bacterias
- Eucariotas
- Virus
- Blog
Antes de hablar de las nuevas variantes de SARS-CoV-2 veamos las diferencias entre variante y cepa. Porque no, no son iguales, y se usan en muchos medios como si fueran sinónimos. Además, veremos también que son las mutaciones y los clados (o clusters), términos de utilidad al hablar de los virus.
Índice de contenidos
Cambios genéticos que aparecen en los virus (y en los seres vivos). Cuando un virus se replica (se multiplica) pueden haber fallos y se puede cambiar un nucleótido por otro, habiendo la posibilidad de cambio de la formación de aminoácidos y la función de la proteína. Estos fallos son las mutaciones.
Las mutaciones pueden ser sinónimos o no sinónimos. Si una mutación es sinónimo significa que, aunque haya cambio de un nucleótido, seguirá formandose el mismo aminoácido, por lo cual no hay cambio de estructura, ni de función, de la proteína. Estas mutaciones no son relevantes para cambiar un virus. Ahora bien, si la mutación es no sinónimo el cambio de un nucelótido cambia la formación del aminoácido por otro diferente, cambiando la estructura y la función de la proteína. Estas mutaciones si son biologicamente relevantes.
Los nombres de las mutaciones, cuando son una sustitución, se escriben en el orden XYYYZ, siendo:
Así, por ejemplo, la mutación P681H consiste en la sustitución de prolina (p) por histidina (h) en la posición 681.
Clado (cluster). En el contexto de infección vírica se refiere a un grupo de brotes. Por ejemplo, si hay varios brotes de SARS-CoV-2 en la misma área, esto sería sería un cluster. El cluster se formaría entre virus de la misma especie con aspectos en común.
Variante o linaje. Dentro de una especie hay diferencias y se forman subespecies. Las variantes serían las "subespecies" de los virus. Los virus tienen mutaciones continuamente; estas mutaciones se podrían agrupar para formar variantes de una especie, o variantes de una cepa como veremos. Para estudiar y agrupar y las variantes (y las cepas) se usan los árboles filogenéticos. Así, a las variantes de los virus en función de su composición genético y del momento en el que han aparecido. Partamos del virus SARS-CoV-2 en España. En España se introdujeron en Enero y Febrero alrededor de 62 variantes de SARS-CoV-2 agrupadas en 3 clusters. El cluster* conocido como 19B fue más común en España que en el cualquier otro país de Europa por el llamado "efecto fundador". No obstante, aparecieron variantes del virus con una mutación en la posición 614 de la proteína S del virus (D614G) que les daba una mayor capacidad infectiva. Dichas variantes acabaron sustituyendo a las primeras variantes observadas en España.
*Podrás observar que hay textos donde cluster, linaje y variante se usan como sinónimos. En ese caso, dichas palabras se usarían para definir un grupo de virus con aspectos en común. No obstante una variante específica siempre será una variante o un linaje.
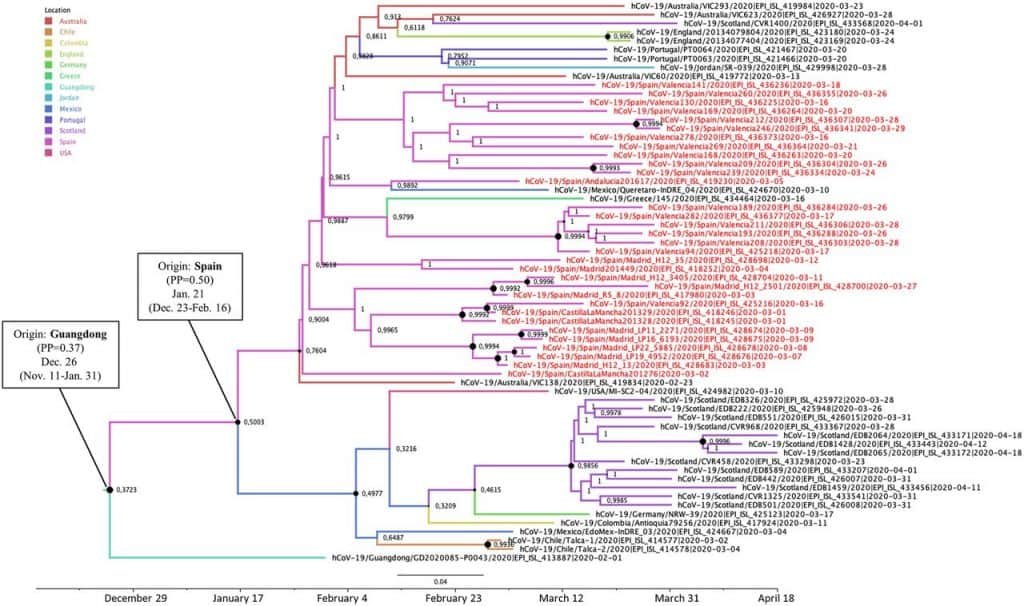
Cepa. Si las mutaciones dadas en el virus son drásticas, y hacen este sea muy diferente de SARS-CoV-2 y no se les pueda considerar el mismo virus, se formaría una nueva cepa. En otras palabras, sería otra especie. Por ejemplo, dentro de la familia de los coronavirus tenemos a SARS-CoV, MERS-CoV-2 y SARS-CoV-2, entre otros. Estas serían cepas de coronavirus. Buscando un símil en el mundo animal, el elefante africano y el elefante asiático serían "cepas" (especies) de la familia de los elefantes (Familia Elephantidae).

Las mutaciones pueden ser buenas o malas para el virus. Si son inútiles para el virus, estos irán desapareciendo, y con ellos dichas mutaciones. Pero si las mutaciones son útiles los virus con dichos cambios permaneceran en el tiempo. La tendencia de los virus es de mutar a formas más infectivas, más transmisibles, pero menos letales. Y es que, a más letalidad, menor rango de movimiento de los hospedadores. Un virus que provoca síntomas leves hace que la gente tenga su vida normal. Un virus con síntomas graves si que te hace parar. Ya sea en tu casa o en un hospital, el virus más letal "se mueve menos" que el virus con síntomas más leves. Al final, el objetivo del virus es trasmitirse lo máximo posible; y para ello son más efectivas las formas más infectivas pero menos letales.
Como hemos visto, hay muchas variantes del virus, ya que hay mutaciones continuas. Ahora bien, no suelen tener mayor incidencia en su hospedador (en este caso, nosotros). Sin embargo, en estos últimos meses han salido a la palestra 3 variantes de SARS-CoV-2 que parecen ser más transmisibles, teniendo diferencias que son importantes porque nos afectan de forma significativa. Dichas variantes son más transmisibles, además de haber un temor infundado a que dichos linajes puedan volver infectar a personas que ya se hayan recuperado de COVID-19.
El linaje B.1.1.7 (también conocido como VOC 202012/01 o 20I/501Y.V1) se detectó en el Reino Unido, destacando por un crecimiento rápido, apareciendo por diversas zonas de Reino Unido durante las primeras 4 semanas tras su detección. Se relacionó la presencia de B.1.1.7 con un mayor número de casos de COVID-19 en dichas partes de Reino Unido. Esta variedad destaca por tener un número inusual de cambios genéticos (23 mutaciones), en especial en la proteína S. Las mutaciones a destacar son:
Se determinó que el linaje con la mutación 501Y era un 10% más transmisible. Cuando apareció la delección de los aminoácidos de las posiciones 69-70 estas variantes eran entre un 70-80% más transmisibles. De hecho, a fecha de 14 de diciembre de 2020 ya estaba en más de 30 países; actualmente son más, y se sospecha que será la variante dominante en muchos de ellos. No hay evidencia de que haya aumentado la letalidad con esta variante (tampoco de que haya descendido).
Sobre las vacunas, se hizo un estudio sobre la vacuna de Pfizer y BioNTech y no se mostró pérdida en la eficacia de los anticuerpos neutralizantes para la mutación N501Y. No obstante, hacen falta más estudios comprobando si se mantiene la misma efectividad con el resto de mutaciones críticas. Moderna ha afirmado que su vacuna sigue teniendo actividad neutralizante frente a la variante de Reino Unido, así como a la de Sudáfrica.
La variante 501Y.V2 apareció en Sudáfrica después de la primera ola, afectando especialmente al área metropolitana de la bahía Nelson Mandela. Este linaje tiene 8 mutaciones críticas en la proteína S, destacando 3 en residuos importantes del dominio RBD: las mutaciones K417N, E484K y N501Y.
Esta variante se relaciona con un aumento de la transmisibilidad ya que llegó a ser la variedad dominante en Sudáfrica en pocas semanas, y llegando a dispersarse, tanto por países vecinos como Bostswana, como en países europeos, Corea del Sur, e incluso Australia en 2021.
Sobre las vacunas, se hizo un estudio sobre la vacuna de Pfizer y BioNTech y no se mostró pérdida en la eficacia de los anticuerpos neutralizantes para la mutación N501Y. No obstante, hacen falta más estudios comprobando si se mantiene la misma efectividad con el resto de mutaciones críticas. Moderna ha afirmado que su vacuna sigue teniendo actividad neutralizante frente a la variante de Sudáfrica, así como a la de Reino Unido.
Esta nueva variante se detectó en Manaos, zona amazónica del norte de Brasil. El nombre más común es P.1, y es descendiente de B.1.1.128. Tiene un conjunto de mutaciones críticas en su linaje, incluyendo las mutaciones E484K, K417T, and N501Y:
Este cluster apareció en el 42% de los positivos en pruebas RT-PCR entre el 15 y el 23 de diciembre. No obstante, no apareció en ninguna de las muestras de los genomas del virus recogidos entre marzo y noviembre de 2020. Esto llevó a pensar a los investigadores la posibilidad de una variante en la región del Amazonas. La detección de nuevos casos en Japón de pacientes que vinieron de Manaos sugirieron dicho origen de esta variante. Es especialmente preocupante por el hecho de volver a infectar a una gran número de personas en la región de Manaos, lugar donde, tras haber sido afectado anteriormente por SARS-CoV-2, estaba muy cerca de conseguir la inmunidad de rebaño
Al ser una variante recién descubierta, aun hacen falta más análisis y estudios para conocerla mejor.
Chen, Y., Liu, Q., & Guo, D. (2020). Emerging coronaviruses: Genome structure, replication, and pathogenesis. Journal of medical virology, 92(4), 418–423. https://doi.org/10.1002/jmv.25681
Díez-Fuertes, F., Iglesias-Caballero, M., García-Pérez, J., Monzón, S., Jiménez, P., Varona, S., Cuesta, I., Zaballos, Á., Jiménez, M., Checa, L., Pozo, F., Pérez-Olmeda, M., Thomson, M. M., Alcamí, J., & Casas, I. (2021). A Founder Effect Led Early SARS-CoV-2 Transmission in Spain. Journal of virology, 95(3), e01583-20. https://doi.org/10.1128/JVI.01583-20
Faria N. R., Morales I., Candido D., Franco L. A. M., Andrade P. S., Coletti T. M., Silva C. A. M., Sales F. C., Manuli E. R., Aguiar R. S., Gaburo N., Camilo C. C., Fraiji N. A., Crispim M. A. E., Carvalho M. S. S., Rambaut A., Nick Loman N., Pybus O. G., Sabino E. C., on behalf of CADDE Genomic Network11 (2021) Genomic characterisation of an emergent SARS-CoV-2 lineage in Manaus: preliminary findings. Virological. Disponible en: https://virological.org/t/genomic-characterisation-of-an-emergent-sars-cov-2-lineage-in-manaus-preliminary-findings/586/1
Galloway, S. E., Paul, P., MacCannell, D. R., Johansson, M. A., Brooks, J. T., MacNeil, A., Slayton, R. B., Tong, S., Silk, B. J., Armstrong, G. L., Biggerstaff, M., & Dugan, V. G. (2021). Emergence of SARS-CoV-2 B.1.1.7 Lineage - United States, December 29, 2020-January 12, 2021. MMWR. Morbidity and mortality weekly report, 70(3), 95–99. https://doi.org/10.15585/mmwr.mm7003e2
Leung, K., Shum, M. H., Leung, G. M., Lam, T. T., & Wu, J. T. (2021). Early transmissibility assessment of the N501Y mutant strains of SARS-CoV-2 in the United Kingdom, October to November 2020. Euro surveillance : bulletin Europeen sur les maladies transmissibles = European communicable disease bulletin, 26(1), 2002106. https://doi.org/10.2807/1560-7917.ES.2020.26.1.2002106
Moderna. (2021) Moderna COVID-19 Vaccine Retains Neutralizing Activity Against Emerging Variants First Identified in the U.K. and the Republic of South Africa. Consultada por última vez el 1 de febrero de 2021. Disponible en: https://investors.modernatx.com/news-releases/news-release-details/moderna-covid-19-vaccine-retains-neutralizing-activity-against
Rambaut A., L. N., Pybus O, Barclay W, Carabelli A. C., Connor T., Peacock T., Robertson D. L., Volz E., on behalf of COVID-19 Genomics Consortium UK (CoG-UK). (2020) Preliminary genomic characterisation of an emergent SARS-CoV-2 lineage in the UK defined by a novel set of spike mutations. Virological. Disponible en: https://virological.org/t/preliminary-genomic-characterisation-of-an-emergent-sars-cov-2-lineage-in-the-uk-defined-by-a-novel-set-of-spike-mutations/563
Tang, J. W., Toovey, O., Harvey, K. N., & Hui, D. (2021). Introduction of the South African SARS-CoV-2 variant 501Y.V2 into the UK. The Journal of infection, S0163-4453(21)00030-X. Advance online publication. https://doi.org/10.1016/j.jinf.2021.01.007
Tegally, H., Wilkinson, E., Giovanetti, M., Iranzadeh, A., Fonseca, V., Giandhari, J., Doolabh, D., Pillay, S., San, E. J. & Msomi, N. (2020) Emergence and rapid spread of a new severe acute respiratory syndrome-related coronavirus 2 (SARS-CoV-2) lineage with multiple spike mutations in South Africa. medRxiv. https://doi.org/10.1101/2020.12.21.20248640