Análisis del crecimiento microbiano
En cualquier sistema biológico el crecimiento se define como el aumento ordenado de todos los constituyentes que conforman el organismo. No implica necesariamente aumento de masa, porque puede deberse simplemente a la síntesis de inclusiones de reserva, puede deberse también a que los biopolímeros esenciales de la célula se estén sintetizando.
En un medio definido una población bacteriana experimenta un crecimiento equilibrado en el cual la duplicación de biomasa implica la duplicación de todos componentes, por lo tanto podemos medir la velocidad de crecimiento como la velocidad de síntesis de cualquier componente esencial. De aquí se deduce un parámetro muy importante que es el llamado tiempo de generación (g) que es el tiempo que una población microbiana tarda en duplicarse o que una célula tarda en dividirse.
En general, el crecimiento en microbiología lo vamos a considerar como un crecimiento poblacional, es decir, como el incremento en el número de células que componen la población. Ese incremento implica división por fisión binaria.
El crecimiento a nivel celular: incremento en el peso y tamaño de una célula.
Índice de contenidos
Expresión matemática del crecimiento microbiano
En un medio determinado, una población inicial de células (N0) que se divide en un tiempo t alcanzará un tamaño N. N0=1.
En la generación 1 el tamaño de la población será N=2 o N=1x21
En la generación 2 el tamaño de la población será N=4 o N=1x22
En la generación 3 el tamaño de la población será N=8 o N=1x23
En la generación ‘n’ el tamaño de la población será N=2n
En una generación N=N0x2n siendo n el número de generaciones, n=
N= N0·2n
N= N0 ·2t/g
Log N= log N0 + log2t/g
Log N= log N0 + t/g·log 2
t/g x log 2= log N – log N0
g (Horas o min) *g siempre va en unidad de tiempo.
En microbiología usamos el concepto de crecimiento poblacional, no crecimiento individual. Nos guiamos por el crecimiento de la población. El crecimiento microbiano es una función exponencial. El incremento del número de células que forman la población es siempre proporcional al número de células de partida. Esta es la expresión:
dN/dt= µ*N
µ. Constante especifica de crecimiento. Nos indica la constante de crecimiento de un cultivo exponencial.
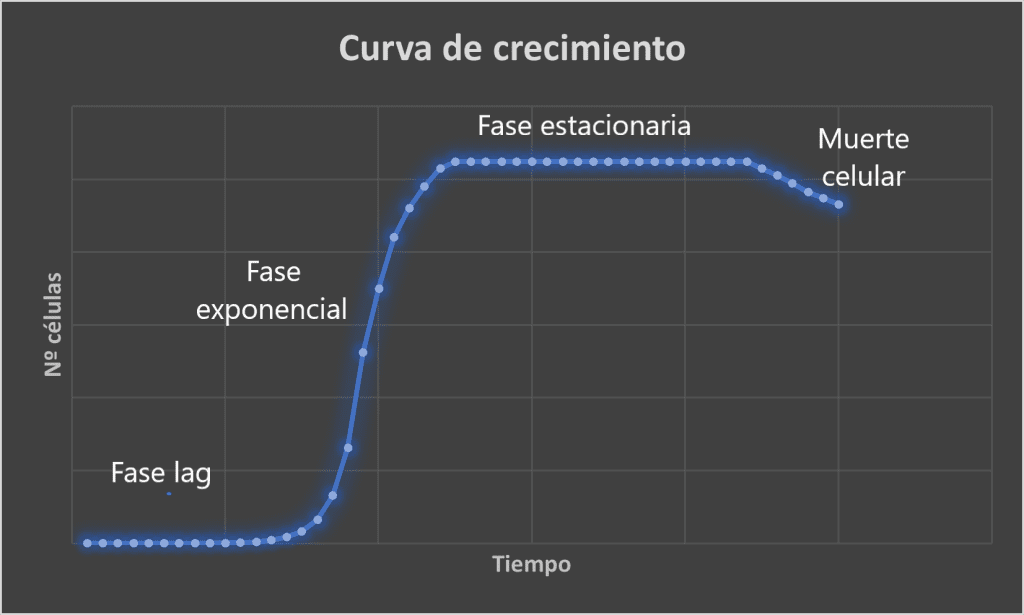
Curva de crecimiento microbiano
Si partimos de un cultivo microbiano en un medio nutritivo cerrado (la composición de nutrientes es fija y no hay renovación de nutrientes ni tampoco cambio en las condiciones ambientales de cultivo) obtendremos una cinética de crecimiento en la que distinguimos 4 fases:
- Fase lag o fase de latencia. Es una fase de adaptación de los microorganismos al medio. Aunque no hay crecimiento neto (no hay aumento de células), esta fase es metabólicamente muy activa. Las células reconocen los nutrientes disponibles y comienzan a transcribir los mRNA necesarios para utilizarlos. Al mismo tiempo las células bloquean la expresión de aquellas enzimas que no necesitan. La duración varía según el microorganismo y según el medio. Inmediatamente después el cultivo entra en una fase exponencial.
- Fase exponencial. El cultivo empieza a dividirse a su máxima capacidad genética. Las células se duplican ‘’todo lo que pueden’’. Esta fase también se llama de crecimiento equilibrado, donde la división celular se correlaciona con la duplicación de todos los componentes celulares. La pendiente de esta fase exponencial viene definida por µ. No es un parámetro fijo para cada microorganismo: depende del medio y las condiciones de cultivo. Por lo tanto, la pendiente será distinta. Llega un momento en el que el crecimiento exponencial se agota y el cultivo entra en una fase estacionaria.
- Fase estacionaria. En esta fase el crecimiento es desequilibrado: hay unas células que se están dividiendo, otras que se están muriendo, y los componentes celulares se sintetizan a distinta velocidad. El incremento del número de células con respecto al tiempo es cero (dN/dt=0). Las células estacionarias son en su estructura y composición química distintas a las exponenciales: las células estacionarias son más pequeñas, han perdido refringencia y son mucho más resistentes a las agresiones ambientales del medio (calor, oxidantes, antibióticos,…). Es más interesante que la exponencial porque la mayor parte de los productos y sustancias de interés clínico y comercial son los metabolitos secundarios que se sintetizan en esta fase. Los cultivos que van a endosporular, la diferenciación a endospora ocurre siempre al final de esta fase. Entra aquí por dos razones:
- Porque se agota algún nutriente esencial, que de alguna manera es el limitante del crecimiento.
- Porque empiezan a liberarse al medio productos de desecho (tóxicos a veces).
- Muerte celular. El agotamiento de nutrientes es máximo y la acumulación de productos de desecho se hace demasiado tóxica: la mayor parte del cultivo comienza a morirse. Es también una fase exponencial de pendiente negativa.
Métodos para valorar el crecimiento microbiano
Vamos a medir el crecimiento poblacional a partir del crecimiento celular. Vamos a seguir dos parámetros:
- Número de células. Distinguimos entre el recuento de células totales, donde no se diferencia entre células vivas y células muertas, y el recuento de células viables, donde solo se cuentan las células vivas. Definimos que una célula está muerta cuando pierde la capacidad de dividirse. Definimos una célula viable aquella que aún puede dividirse. Para ello medimos el recuento total de células con un hemocitómetro que son unos portas especiales que llevan en el centro una cuadrícula graduada. Es un método directo e inmediato y rápido. Inconvenientes: no distinguimos si las células están vivas o muertas, hablamos de células totales. También se puede usar una cámara de recuento o con un contador electrónico (o de Coulter). El contador de Coulter es electrónico y cuando una célula pasa por el contador la detecta y emite una señal eléctrica y así las va contado. Tampoco distingue células vivas de células muertas. Para hacer recuento de viables se usa el recuento en placa por método de extensión en placa, vertido en placa o recuento en filtros de membrana (todos estos métodos es sólo de células vivas). Se cuentan unidades formadoras de colonias por ml. El inconveniente es que no es un método inmediato: hay que incubar y generalmente esperar 24h para poder hacer la observación. El número de unidades formadoras por placas debe de estar entre 30-300. El recuento en filtros se aplica a grandes volúmenes. Se pasa el volumen que se va a filtrar y se recoge el medio estéril porque todas las células bacterianas se quedan en el filtro. Se coge el filtro y se lleva a una placa de petri, se incuba y al día siguiente empiezan a crecer colonias.
- Otro tipo de medir es a través de la masa celular, por turbidimetría (fotómetro, espectofotómetro, nefelómetro). Se mide la turbidez: a mayor turbidez=mayor absorbancia=mayor número de microorganismos. Es un método inmediato, podemos hacer una relación entre la absorbancia de las células y la masa. Otro método es por peso seco. Tenemos un volumen celular que se filtra y, en lugar de incubarlo, se va evaporando el agua y se pesa hasta que el peso es constante (agua evaporada) y sólo queda el peso celular.
Cultivo continuo
Nunca en un cultivo continuo los microorganismos se dividen más rápidamente de lo que no haría en un cultivo cerrado.
En la mayor parte de las industrias lo que se emplea es un cultivo continuo o abierto en el cual tenemos una vasija donde están las células con el medio, un dispositivo de entrada desde el cual se le están aportando nutrientes al medio y un dispositivo de salida por el cual se pierde el afluente de las células y el medio. La vasija debe estar estéril. El medio se inocula con el organismo que vamos a crecer y pasando una fase lang llega un momento en el que el cultivo alcanza un punto en el cual se puede mantener en fase exponencial indefinida, y se alcanza un equilibrio o steady-state, con una biomasa es constante.
En el cultivo continuo hay un parámetro clave que se denomina velocidad de dilución que es directamente proporcional al flujo de entrada en un volumen de medio de un determinado tiempo e inversamente proporcional al volumen de la vasija. También se expresa como horas a la menos 1.
Hay dos modalidades:
- El turbidostato. Se fija para el cultivo una determinada absorbancia o turbidez celular. El sistema esta acoplado a un espectrofotómetro, el cultivo deber estar autocontrolado. Las células se dividen con mucha rapidez y aumenta el valor fiado por el espectrofotómetro, la sonda avisa y cierra la entrada de nutrientes, entonces entran menos nutrientes y el cultivo empieza a dividirse más lentamente. El tiempo de generación aumenta y la densidad óptica baja hasta igualarse al valor requerido. Apenas se usa. El rendimiento en producto obtenido en función del sustrato suministrado es bajo ya que estamos perdiendo una parte de las células y del medio sin transformar. Para que el rendimiento aumente se ha inventado el quimiostato.
- El quimiostato. La velocidad de crecimiento del cultivo depende de un nutriente esencial que generalmente no es la fuente de carbono. Este nutriente suele ser y es en muchos casos un aminoácido, que se añade a una concentración baja pero suficiente para permitir el crecimiento, de tal manera que la velocidad de crecimiento es proporcional a la concentración de ese nutriente y se obtiene un rendimiento optimo. El rendimiento en euros o dólares por biomasa celular es óptimo porque siempre hay un nutriente que se añade a una concentración limitante y es esencial. Se asegura todo lo que invierte le sacan la máxima rentabilidad.
La rentabilidad en producto formado en función del medio que se aporta es máxima. Y no se desperdicia nada de los sustratos añadidos.
Cultivo sincrónico
Aquel en el cual todas las células se están dividiendo a la vez y se encuentran en la misma fase del ciclo celular. Cuando las células se inoculan en un medio nuevo, al principio las divisiones son sincrónicas; esta sincronía se tiende a perder con el tiempo. Cuando llegamos a la fase estacionaria la asincronía es total.
La mayor utilidad de estos cultivos es para investigación: para encontrar reguladores y marcadores específicos del ciclo celular.
Percepción del quórum o quórum sensing
Normalmente, los estudios sobre crecimiento microbiano han asumido que las células ‘’van por libre’’, es decir, que en una población en crecimiento se asume que las células actúan independientemente unas de otras (no se comunican entre ellas).
No obstante, en el estudio llevado a cabo por J. W. Hastings y colaboradores en 1966, descubrieron esta característica en Vibrio fischeri. Es un fenómeno de regulación, o control, de multicelularidad. Las células se comunican y coordinan sus actividades para actuar como una unidad, lo que implica una ventaja adaptativa.
Intervienen una serie de moléculas sensoras, denominas moléculas autoinductoras o de quórum, que solamente alcanzan un nivel crítico (quorum) cuando hay un número suficiente de células. En ese momento se activa la expresión génica.
Se cree que hay una cantidad de actividades fisiológicas microbianas que dependen de la percepción de quórum (producción de enzimas extracelulares, producción de antibióticos, la esporulación, la virulencia,...).
En GRAM negativas hay producción del autoinductor acilo homoserina lactona (AHL) que provoca:
- Emisión de luminiscencia (Vibrio fischeri)
- Secreción de sustancias viscosas (biofilms, Pseudomonas aeruginosa)
- Inicio de formación de nódulos radicales (Rhizobium)
- Transferencia de material genético (Agrobacterium tumefaciens)
- Producción de factores de virulencia (Erwinia carotovora)
Mientras, en GRAM positivas se producen oligopéptidos que generan:
- Conjugación (Enterococcus faecalis)
- Inducción del estado de competencia, recepción de ADN (Streptococcus pneumoniae)
- Estimulación de la esporulación (Bacilllus subtilis)
- Producción de exotoxinas y otros factores de virulencia (Staphylococcus aureus)
- Estimulación del desarrollo micelial (Streptomyces griseus). La γ-butirolactona sirve de señal intercelular.
