Tras ver la teoría sobre colorantes y tinciones vamos a analizar las principales tinciones usadas en microbiología y los colorantes que las forman.
En este caso, las diferentes técnicas de tinción analizadas se usan para el microscopio óptico. La mayoría de las muestras se podrán ver en el microscopio con aumentos de 20x y 50x, aunque habrán casos donde será necesario usar el aumento 100x (donde se añade también el aceite de inmersión a la muestra).
Las tinciones principales son la de Gram y de Ziehl-Neelsen, ambas diferenciales; aunque también hay otras tinciones diferenciales y selectivas de interés para la microbiología.
Recordatorio: antes de leer este artículo sería bueno que conozcas un poco de teoría sobre las fases, mecanismos y tipos de tinciones que hay (además de las partes que tienen los colorantes). Si conoces todo esto podrás entender mejor ciertas expresiones que son más del gremio 😄.
Índice de contenidos
Tinción de Gram
La tinción de Gram es probablemente la más conocida; es de tipo diferencial y sirve para distinguir a los microorganismos por morfología y composición.
Hay que tener en cuenta que se debe hacer la tinción cuando el cultivo esta en fase exponencial, ya que en fase estacionaria (“vejez”) se pueden confundir las gram positivas con las negativas. Esto ocurre debido a la perdida de capas de peptidoglicano por parte de bacterias gram positivas.
Colorantes
- Cristal violeta. Da color azul o violáceo a las bacterias gram positivas.
- Safranina. Da color rojizo o anaranajado a las bacterias gram negativas.
Aparte de estos colorantes, en la tinción de Gram se usará el lugol como mordiente, y alcohol 96% para decolorar. Todas las células (sean Gram positivas o negativas) se teñirán con el cristal violeta.

Ahora bien, el alcohol quita fosfolípidos y cierra los poros de la pared celular, por lo que el cristal violeta queda atrapado. Las bacterias gram positivas podrán soportar este proceso gracias a su gran capa de peptidoglicano. No obstante, las bacterias Gram negativas no aguantarán este tratamiento con alcohol, por lo que se quitará el cristal violeta de ellas.
Preparación
El proceso de tinción consta de los siguientes pasos:
- Con el asa de cultivo se cogen varias cargas (colonias, células bacterianas), y se extienden por el portaobjetos. No se añade agua destilada.
- El proceso de fijación se realiza por calor a la llama.
- Se añade cristal violeta, recubriendo con este colorante el portaobjetos durante 2 o 3 minutos.
- Ahora se añade lugol (yoduro potásico 2% + yodo) durante 1 minuto. El lugol no es un colorante en sí, sino que hace de mordiente. El mordiente se acopla con el colorante y facilita su absorción por parte del microorganismo.
- Se lava el portaobjetos con agua destilada. El agua no debe tocar directamente la muestra.
- Decolorado con alcohol 96%. Se añade el alcohol gota a gota, y de la muestra saldrán gotas violáceas. Paramos de añadir alcohol cuando salga la primera gota transparente de la muestra.
- Se añade el colorante de contraste, la safranina, durante 5 minutos.
- Por último se lava el portaobjetos y se seca.
Utilidades
La principal utilidad de la tinción de Gram es la de distinguir entre bacterias gram positivas y negativas. Las gram negativas que perdieron coloración por el tratamiento con alcohol ahora se verán de color rojo, naranja o rosáceo por acción de la safranina. Por otra parte, las bacterias gram positivas teñidas con cristal violeta tendrán un color azulado o violáceo.
Gram positivas
Las siguientes especies son las gram positivas más representativas:
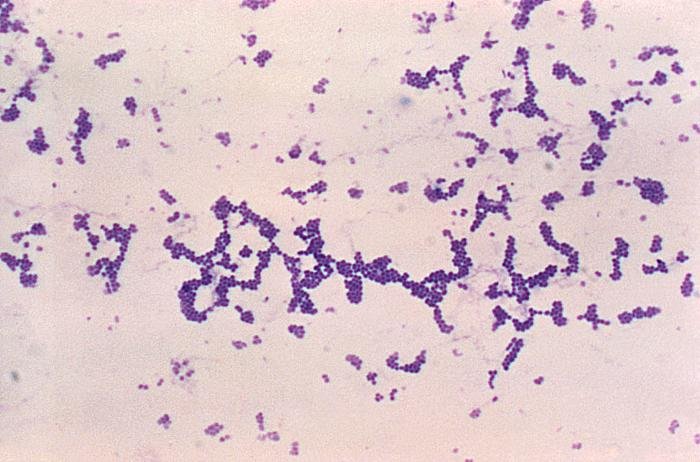
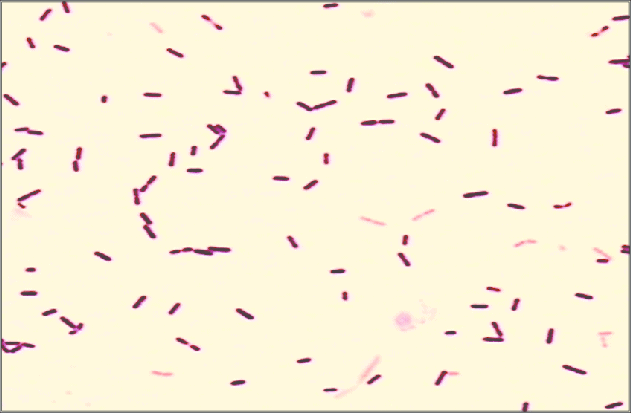
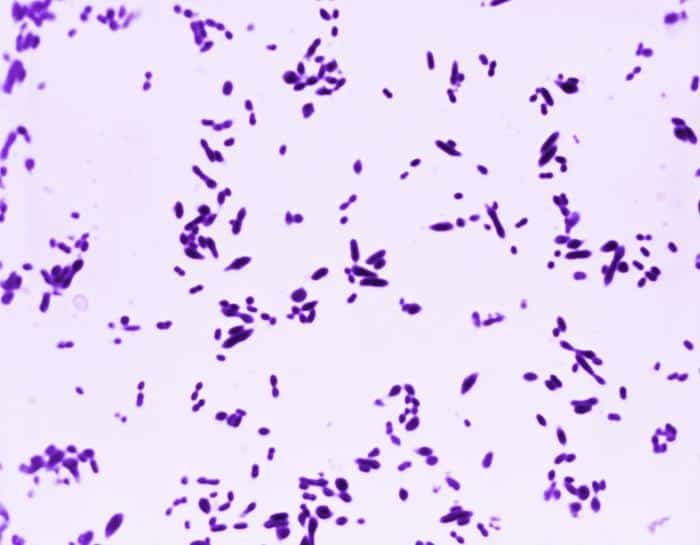
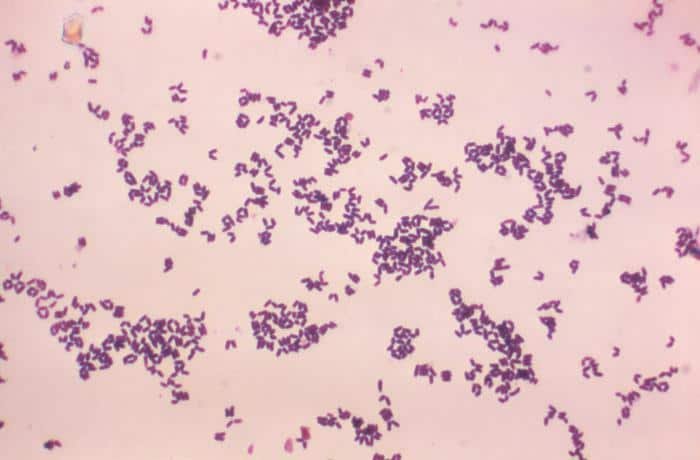

Quizá eches de menos a Mycobacterium tuberculosis. Es cierto, que es una bacteria gram positiva. No obstante, no se detecta bien con la tinción de gram. Hace falta otra tinción diferencial (tinción de Ziehl-Neelsen) que veremos más adelante.
Gram negativas
A continuación veremos algunas de las bacterias gram negativas más comunes:
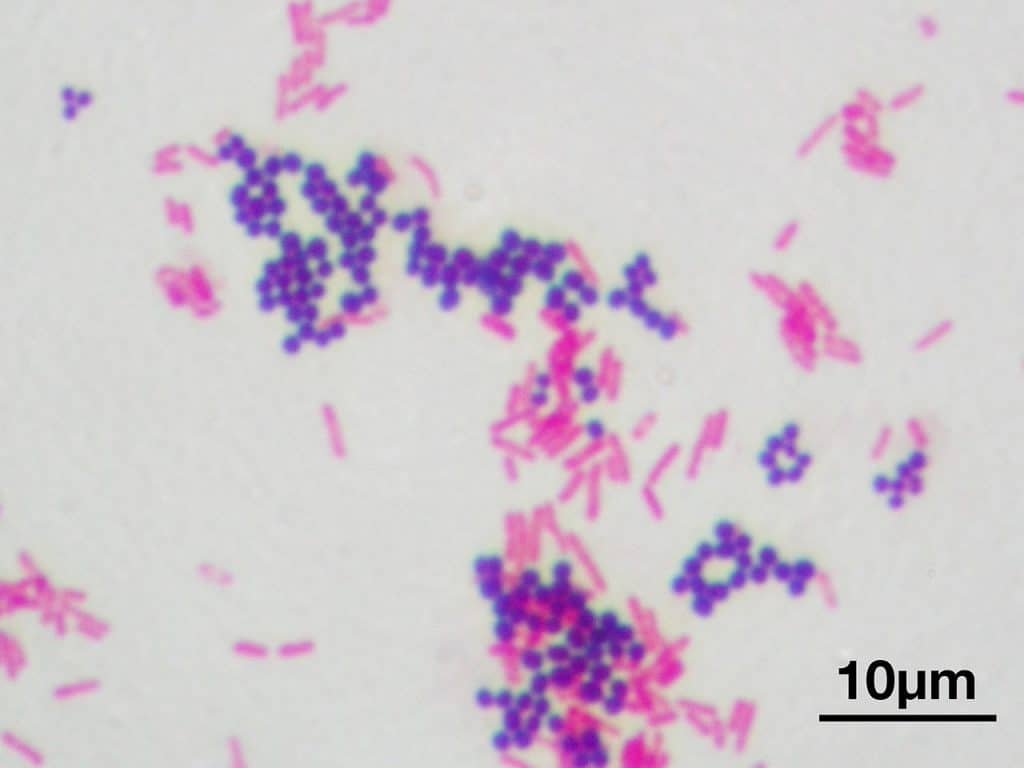
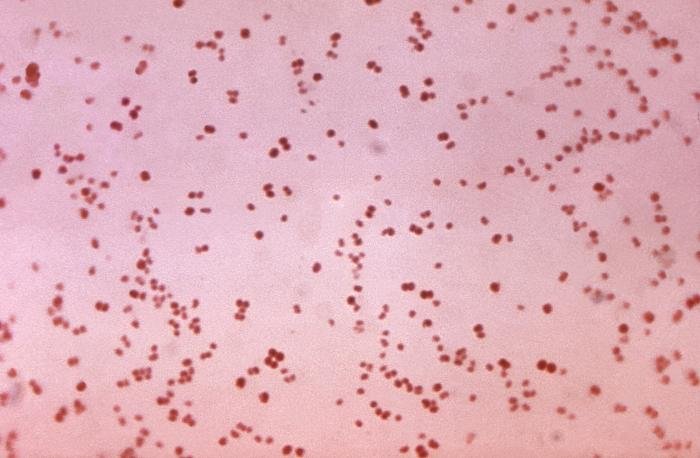
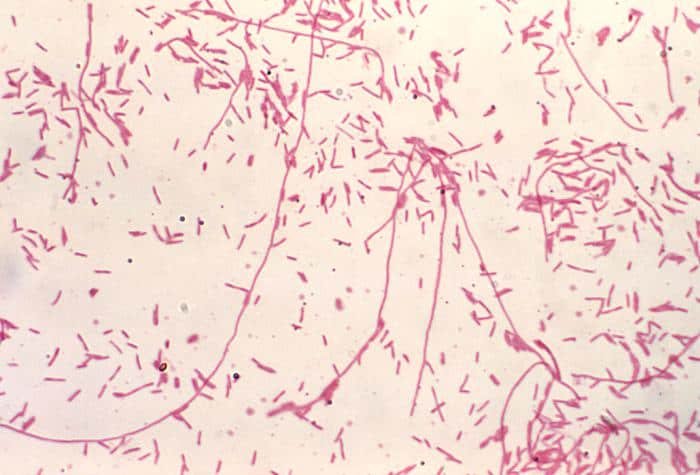

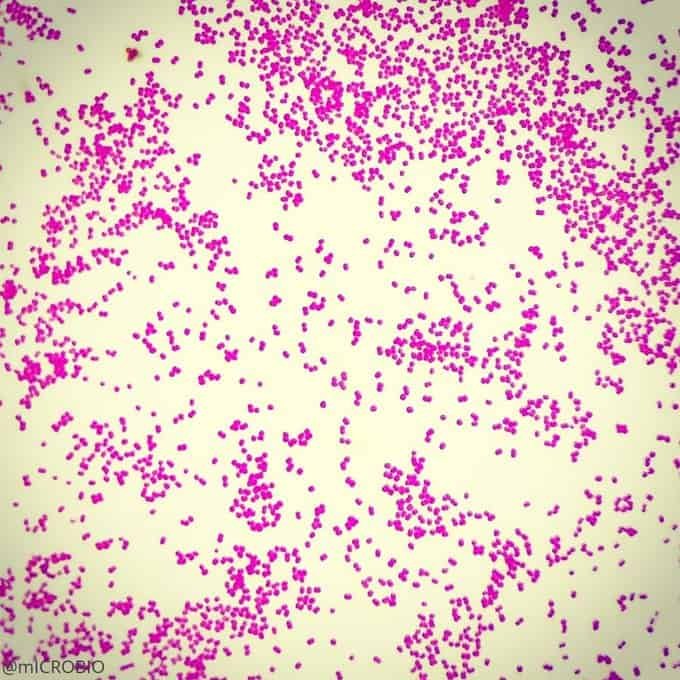
Recordatorio: las bacterias gram positivas se tiñen de azul (azul oscuro o violeta), mientras que las bacterias gram negativas se tiñen de rojo (rojo, anaranjado o rosado). A lo mejor lo tienes claro; pero en mi caso personal casi siempre las confundía. Por eso he puesto el color respectivo en cada frase, para que lo recuerdes mejor si te pasa igual que me pasaba a mí. 😉
Tinción Ziehl-Neelsen
La tinción de Ziehl-Neelsen es de tipo diferencial, y sirve para detectar bacterias ácido-alcohol resistentes (BAAR), siendo la más destacada Mycobacterium tuberculosis. Esto es muy útil, sobre todo teniendo en cuenta que M. tuberculosis no puede ser detectada correctamente con la tinción de Gram.
Lo que hace diferentes a estas bacterias es la presencia de un polímero (ácidos micólicos) que se une a azúcares, lo que provoca que el conjunto de la pared sea muy impermeable.
Colorantes
- Fucsina fenicada. Da un color rojizo a las bacterias AAR.
- Azul de metileno. Da un color azulado al resto de bacterias que no son AAR.
En la tinción de Ziehl-Neelsen, el alcohol-ácido cumple la una función parecida a la del alcohol 96% en la tinción de Gram. En este caso, el contraste aparece por los ácidos micólicos, que hacen que sus bacterias sean impermeables al alcohol-ácido. Las bacterias que no cuenten con estos ácidos micólicos se decolorarán por acción del alcohol, y la fucsina saldrá de éstos.
Preparación
El proceso de tinción consta de los siguientes pasos:
- Con el asa de cultivo se cogen varias cargas (colonias, células bacterianas), y se extienden por el portaobjetos. No se añade agua destilada.
- Se fija la muestra con calor.
- Se añade fucsina fenicada, cubriendo totalmente el portaobjetos durante 3 minutos.
- Más tarde, se pasa el mechero varias veces, durante 5 minutos, pero sin permitir que hierva el colorante, ni que se seque, ya que sino el colorante se consume.
- El exceso de colorante se quita con agua destilada.
- Se añade alcohol-ácido para la decoloración durante 10 minutos a intervalos de 1 minuto y medio.
- Ahora se añade el colorante de contraste, el azul de metileno, durante 3 minutos.
- Por último, se lava el portaobjetos y se seca al aire.
Utilidades
La principal función de la tinción de Ziehl-Neelsen es la detección de micobacterias, tales como las provocadoras de tuberculosis (M. tuberculosis) o la lepra (M. leprae). También hay otras micobacterias que, si bien no son patógenas, sí que pueden ser patógenos oportunistas en determinadas circunstancias.
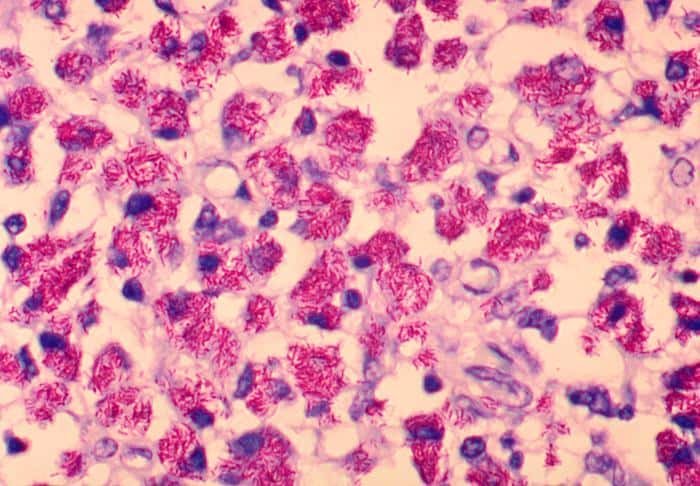
Además, se pueden detectar corinebacterias de gran interés para la biotecnología por su producción de aditivos, o a Streptomyces, formadora de diversos antibióticos. Nocardia y Actinomices también pueden aparecen como bacterias ácido-alcohol resistentes.
Las células bacterianas teñidas con fucsina aparecerán con un color rojo fuego, mientras que las teñidas con azul de metileno tendrán un color azulado.
Tinción de Wirtz-Conklin
La tinción de Wirtz-Conklin se usa para observar bien las endosporas bacterianas. La muestra debe ser obtenida de un cultivo en fase estacionaria. En este caso, para su observación al microscopio hay que usar la lente x100, usando aceite de inmersión.
Entra en el grupo de las tinciones selectivas, aunque al añadir un colorante de contraste es tecnicamente una tinción diferencial.
Colorantes
- Verde malaquita. Tiñe las endosporas de verde.
- Safranina. Es opcional, y sirve para colorear el resto de la célula con un color anaranjado.
Preparación
El proceso de tinción consta de los siguientes pasos:
- Con el asa de cultivo se cogen varias cargas (colonias, células bacterianas), y se extienden por el portaobjetos. No se añade agua destilada.
- Se fija la muestra con calor.
- Se añade verde malaquita, cubriendo totalmente el portaobjetos durante 9 minutos.
- Ahora se aplica calor de 3 a 6 minutos para que el colorante entre en las paredes de la endospora. El calor es aplicado hasta que aparezcan emisión de vapores.
- Se lava con agua el portaobjetos para retirar el colorante de la célula (a excepción de las endosporas).
- Ahora se añade el colorante de contraste, la safranina, durante 5 minutos.
- Por último, se lava con agua y se seca el portaobjetos.
Utilidades
Se usa para observan las endosporas bacterianas, estructuras de resistencia que forman algunas bacterias para sobrevivir en condicione ambientales extremas donde no pueden hacer su ciclo de vida normal. Así, se pueden ver las endosporas que forman Bacillus anthracis y Clostridium perfringens, entre otros.
Las endosporas no absorben la mayoría de los colorantes debido a sus cubiertas gruesas e impermeables. No obstante, el verde malaquita puede hacerlo, por lo que las endosporas bacterianas quedarán teñidas de verde mientras que el resto de las células bacterianas tendrán un color rosáceo.

Tinción de Leifson
La tinción de Leifson usa para la observación de flagelos bacterianos; entra dentro de las tinciones selectivas. Tienen un espesor de 0.01 micrones, por lo que son invisibles al microscopio óptico; por ello hace falta esta técnica especial. Para su observación en el microscopio óptico, se debe usar aceite de inmersión y el aumento 100x.
Recalcamos el hecho de esta tinción se usa para ver flagelos bacterianos; los flagelos de organismos eucariotas son más gruesos y pueden verse con tinciones simples o incluso con preparaciones al fresco.
Colorantes
Se usa el colorante de Leifson que está formado por:
- Fucsina básica 95%. Es el colorante en sí mismo.
- Etanol 1.2%.
- Ácido tánico 3%. Tiene función de mordiente.
- Cloruro sódico 1.5%.
- Agua destilada. Aparece en unión a ácido tánico y cloruro sódico, formando parte de sus soluciones.
Las estructuras teñidas aparecen con color rojizo.
Preparación
El proceso de tinción consta de los siguientes pasos:
- Con el asa de cultivo se cogen varias cargas (colonias, células bacterianas), y se extienden por el portaobjetos. No se añade agua destilada. (Previamente se debe haber hecho un círculo en el portaobjetos).
- El proceso de fijación se realiza sin llama durante 5 minutos. No se usa el mechero ya que demasiado calor puede destruir los flagelos.
- Se añaden unas gotas del colorante de Leifson y se espera 15 minutos.
- Ahora se lava el portaobjetos con agua destilada y se seca
Utilidades
Esta tinción se usa para ver a los flagelos, algo esencial para identificar muchas especies. Y es que los flagelos pueden aparecen en número y disposición diferente en las bacterias, de ahí que sean una forma de clasificación de estas (para ver los tipos de bacterias según el número y disposición de flagelos puedes entrar en el artículo de la célula procariota, en la sección “flagelo”).
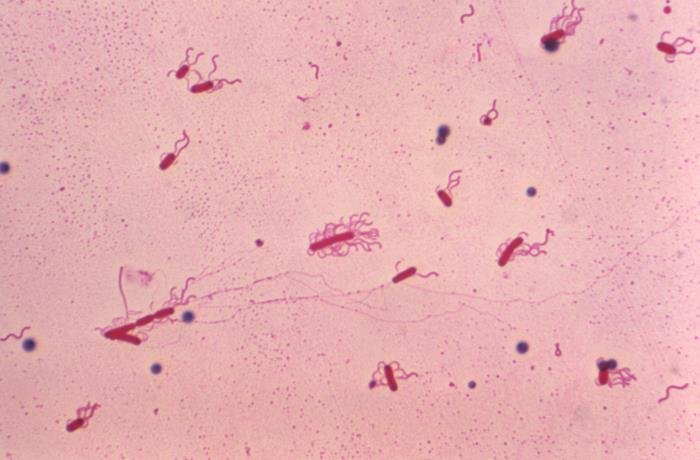
Tinción de Giemsa
Esta tinción es más usada en citología, ya que puede discriminar entre zonas con altos contenidos de ADN, por lo que puede diferenciar diversos orgánulos de la célula; es una tinción diferencial. No obstante, también se usa en microbiología para la detección de ciertas bacterias, destacando Rickettsia.
Colorantes
Colorante de Giemsa. Da un color azul oscuro o violáceo al microorganismo objetivo.
Preparación
El proceso de tinción consta de los siguientes pasos:
- Con el asa de cultivo se cogen varias cargas (colonias, células bacterianas), y se extienden por el portaobjetos.
- El proceso de fijación se realiza con metanol durante 3 o 5 minutos.
- Se añaden unas el colorante de Giemsa y se espera 8 minutos.
- Ahora se lava el portaobjetos con agua destilada y se seca
Utilidades
En microbiología, la tinción de Giemsa detecta a bacterias como Rickettsia y Chlamydia, a protistas como Plasmodium y Pneumocystis, y ciertos hongos, como Histoplasma. Dichos microorganismos se detectan en posibles células infectadas.

Otro patógeno importante que detecta la tinción de Giemsa es Helicobacter pylori, causante de gastritis y úlceras.

No obstante, esta tinción es más usada en citología.
Tinción negativa
Se usa para detectar las cápsulas que aparecen en algunas bacterias, así que entra en el grupo de las tinciones selectivas. La tinción negativa se puede usar para el microscopio óptico o para el microscopio electrónico.
Esta técnica se basa en contrastar las muestras mediante una sustancia opaca en ambos microscopios. Ahora bien, para el microscopio óptico se contrasta la muestra a los fotones, mientras que en el microscopio electrónico se constrasta la muestra a los electrones.
Colorantes
Para el microscopio óptico, principalmente pueden ser dos:
- Tinta china.
- Nigrosina.
Tiñen el fondo de negro.
Preparación
El proceso de tinción consta de los siguientes pasos:
- Se hace una preparación en fresco de la muestra.
- Ahora se añade tinta china.
- Ya se puede observar
Si, de todas las tinciones, es el proceso más corto que hemos visto.
Utilidades
La principal función de la tinción negativa es observar las cápsulas bacterianas. Esto ocurre porque las cápsulas no absorben la tinta china, por lo que estas estructuras aparecen como zonas claras en un fondo negro, oscuro.
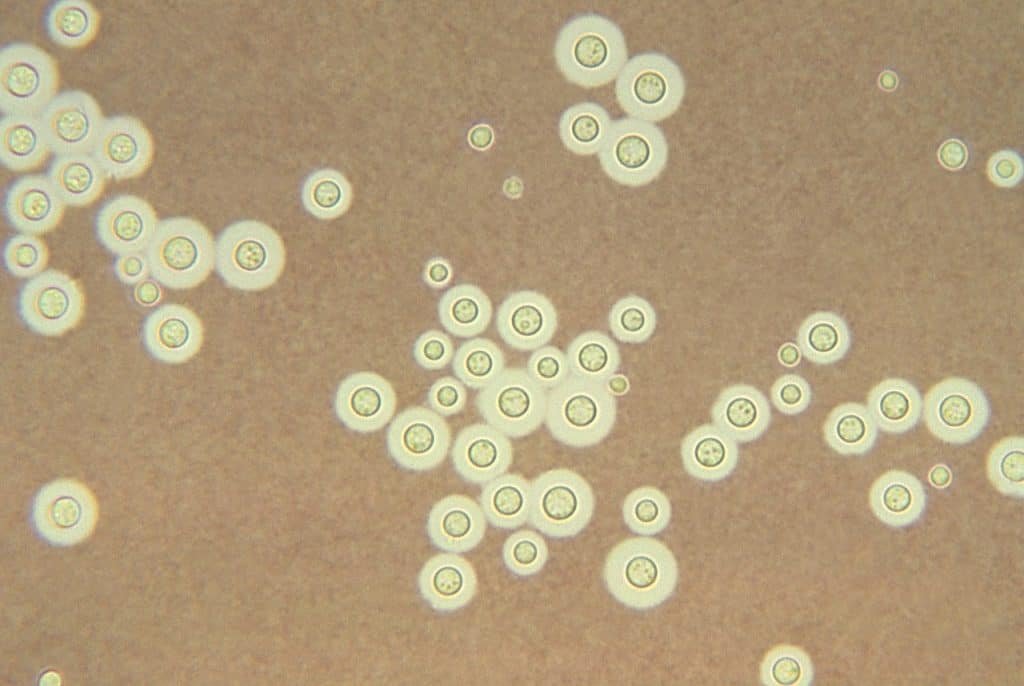
Ahora bien, se pueden añadir algún colorante de contraste para que las células bacterianas sean más visibles. Y, como ya hemos dicho, se puede usar nigrosina en vez de tinta china.
La observación microscópica es crucial en microbiología, permitiendo el estudio detallado de microorganismos. La evolución de los microscopios ha transformado esta disciplina, facilitando la identificación y caracterización de diversas especies.
Además, el uso de diferentes técnicas de tinción ha ampliado las posibilidades de análisis, permitiendo resaltar características morfológicas y estructurales que serían difíciles de apreciar sin estos métodos.
Índice de contenidos
Técnicas de observación microscópica
La microbiología esta indudablemente unida al progreso de los microscopios. De hecho, la historia de la microbiología como ciencia comienza con la creación de microscopios. Para observar mejor a los microorganismos se han desarrollado colorantes, tinciones diferentes que se usarán en función de nuestro objetivo.
Microscopios
Un microscopio es un conjunto de lentes que concentran y enfocan la luz sobre una muestra para formar imágenes visuales. El concepto de microscopio se basa en una propiedad física de la luz: la difracción. Cuando un rayo de luz pasa por dos superficies distintas, que produce una desviación que produce un retraso en la velocidad conocido como índice de refracción, producido entre dos medios cuando la luz pasa a través de ellos.
Fundamentos de microscopía óptica
- Ampliación o aumento. Número de veces que aparece resaltado el tamaño de un objeto y que es el producto de la lente ocular por la objetiva.
- Contraste. Diferencia de intensidad lumínica que hay entre la muestra y el medio. Para aumentar el contraste se recurre a medios de tinción.
- Poder de resolución (PR). Depende de:
- La longitud de onda (λ) de la luz visible usada (entre 0.4 y 0.7 µm)
- La apertura númerica (AN). Es igual a n*sen θ donde
- n. Es el índice de refracción del medio que atraviesa el haz, entre el cubreobjetos y el objetivo. Su valor es:
- 1. En el aire.
- 1.33. En agua.
- 1.5. En aceite de inmersión.
- θ. Es la mitad del ángulo del cono de luz que entra al objetivo desde la muestra.
- n. Es el índice de refracción del medio que atraviesa el haz, entre el cubreobjetos y el objetivo. Su valor es:
- Límite de resolución (LR). Es la distancia mínima que debe existir entre dos puntos para poder diferenciarlos como tales. La ecuación sería esta:
LR = λ / (2n * sen θ)
Con los microscopios normales no se puede observar a menos de 100nm; el objetivo máximo en un microscopio óptico es 100x (solo usando el aceite de inmersión, sino 50x).
Tipos de microscopios
- Microscopio de campo claro. Las muestras se visualizan al destacar sobre un fondo iluminado. Se puede aumentar el contraste sin necesidad de teñir. El contraste entre muestra y medio es muy pobre.

- Microscopio de fondo oscuro. Normalmente en las muestras el contraste entre la célula viva y el agua es muy difícil de resolver con un microscopio de campo claro. Pero este microscopio cambia las condiciones. Se coloca un condensador especial que impide el acceso de luz a la muestra directamente y sólo los rayos oblicuos que inciden son reflejados. Se enfoca un cono hueco de luz sobre la muestra, de modo que sólo la luz reflejada o refractada por la muestra puede formar una imagen. Se observa una imagen con un fondo oscuro y los rayos oblicuos hacen que la muestra se vea iluminada o brillante. Se usa para visualizar microorganismos que son difíciles de teñir por sus características o no se ven con el microscopio normal. Organismos frágiles o que se tiñen muy mal. Ejemplos: La bacteria de la sífilis (Treponema palium) o las espiroquetas que son muy delgadas.
- Microscopía de contraste de fases. Permite visualizar células sin necesidad de tinción. El condensador tiene un diafragma anular que produce un cono hueco de luz, y un objetivo con anillo de fase en una placa cambiadora de fase. Las células tienen un índice de refracción (n) distinto al del medio y desvían los rayos de luz que las atraviesan. La luz que pasa a través de una muestra sufre un retardo. A lo largo del microscopio se intercalan uno o más anillos de fase, que hacen pequeños retrasos en la refracción de la luz cuando pasa de un medio a otro, y los amplifica. Hay dos tipos de luz: la directa y la en fase (retardada). Cuando los dos tipos se integran en el ocular, forman una imagen muy contrastada con áreas muy iluminadas (en fase) y otras muy oscuras (fuera de fase), que va a permitir visualizar la morfología y tamaño de células y composición citoplasmática, Phb, gránulos de volutina, si hay endosporas en formación. Estos componentes no se observan de ninguna otra manera.
- Microscopio de interferencia diferencial. Este microscopio crea una imagen sobre la base de la detección de diferencias entre los n y el espesor de la muestra. Unos prismas generan dos ondas de luz polarizada plana en ángulo recto, una respecto de la otra. Una de las ondas pasa a través de la muestra, y la otra sirve de referencia, y pasa por una zona clara. Tras atravesar la muestra, las dos ondas se combinan e interfieren entre sí; llegan desfasadas al ojo y forman una imagen tridimensional. Si no hay muestra los dos haces llegan al mismo tiempo. Así, diversas estructuras aparecen claramente visibles, tales como paredes celulares, endosporas, gránulos, vacuolas y el núcleo de células eucariotas.
- Microscopio de luz UV. Utiliza una longitud de onda que está en el ultra violeta (200-300nm).
- Microscopio confocal. Usa como fuente de luz los rayos láser. Las muestras se marcan son fluorocromos en general. El rayo láser se dispone en todos los planos de la partícula, va analizando la muestra en distintos planos, y los superpone creándose un registro tridimiensional.
- Microscopía de fluorescencia. Consiste en detectar en la muestra qué emite luz, ya que ciertas moléculas y estructuras son fluorescentes y se excitan con energía radiante. Parte de esa energía que emiten es detectada por el microscopio (por ejemplo, la clorofila, que tienen sustancias fluorescentes naturales). En otras ocasiones se necesita marcar dichas estructuras o moléculas con fluorocromos, tales como la rodamina B o isotiocianato de fluoresceína para poder localizarlas. Un filtro excitador permite pasar la radiación excitada de la longitud de onda (λ) deseada, que es reflejada por el filtro dicroico, y enfocada por la lente del objetivo sobre la muestra. Las móleculas fluorescentes de la muestra se excitan y emiten luz de λ específica y mayor. Esta luz es enfocada por el objetivo y la mayor parte pasa a través del filtro dicroico y no se refleja. Un filtro de barrera final bloquea la luz residual con la frecuencia de la luz de exitación. Su aplicación es en especial en microbiología médica y ecología microbiana.
- Microscopio de fuerza atómica (AFM). Se fundamenta en las interacciones atómicas de las partículas de la muestra que son captadas por un dispositivo situtado muy cerca de la muestra. Se trata de una sonda que se va moviendo sobre la muestra y recoge datos de las repulsiones atómicas (ondas desprendidas). Todo lo que detecta el dispositivo se transmite a través de un sistema informático, y en una pantalla se muestran los resultados tridimensionales.
- Microscopía electrónica. Usa una corriente de electrones que se desplaazan a través de unos lentes electromagnéticos y se van a proyectar sobre una muestra extremadamente fina que tiene que estar en condiciones de vacio extremo.
- Microscopio electrónico de transmisión (MET). Se puede aumentar el contraste mediante la tinción negativa, o los métodos de sombrado o criofractura.
- Microscopio electrónico de barrida (MEB). Útil para ver estructuras en 3 dimensiones.
Microscopio óptico vs Microscopio electrónico
En la siguiente tabla se pueden ver las diferencias entre el microscopio óptico y el microscopio electrónico.
| MO | ME | |
| Aumento | 1.000-1.500 | > 100.000 |
| Resolución máxima | 0,2 µm | 0,5 nm |
| Fuente de radiación | Luz visible | Haces de electrones |
| Lentes | Lentes de vidrio | Lentes electromagnéticas colocadas simétricamente respecto al eje axial que enfocan el haz de electrones, a través de un tubo en el que se ha hecho vacío, sobre la muestra. |
| Fuente de contraste | Absorción de luz diferencial | Dispersión de electrones |
| Medio de desplazamiento | Aire | Alto vacío |
| Montaje de la muestra | Portaobjetos | Rejillas metálicas Tratamiento previo de las muestras |
Observación de microorganismos. Preparaciones
Basicamente, se pueden observar a los microbios mediante 2 tipos de preparaciones:
- Preparación húmeda o fresca. En esta se observan los microorganismos vivos. Es típica de los microscopios de campo oscuro y de contraste de fases. Se usa en caso de que la morfología se altere al usar alguna tinción. Sirve para determinar la movilidad u observar cambios citológicos o algunas inclusiones.
- Preparación teñida. Permite ver a los microorganismos en función de su capacidad para retener o no determinados colorantes. La principal ventaja es que aumenta el contraste, acentuando las características morfológicas pero conservandolas. Los colorantes se usan para formar las tinciones.
Colorantes. Tinciones
Para mejorar el contraste entre los microorganismos y el medio lo que hlacemos es recurrir a las tinciones, tratando las muestras celulares mediante colorantes que son sustancias con una afinidad especial por determinados componentes o estructuras celulares. Como resultado de la tinción lo que vamos a observar son muuestras de microorganismos teñidas más contrastadas sobre un medio difuso (no teñido). En microbiología vamos a utilizar siempre preparaciones fijadas, es decir, muestras de células muertas, y para las tinciones se utilizan colorantes (no tintes).c
Todo colorante lleva dos partes:
- Grupo cromóforo. Parte de la molécula responsable del color, es el radical cromóforo. Se trata de moléculas alifáticas que suelen llevar un doble enlace conjugado (N=N) o un grupo sulfo (SO2).
- Grupo auxocromo. Región de la molécula que no tiñe pero que facilita la interacción del radical cromóforo con la molécula que va a teñir. Suelen ser radicales iónicos (OH–, COO–, NH2+) muy activos con capacidad para interactuar.
Los colorantes se van a clasificar en función del grupo auxocromo:
- Grupo auxocromo ácido o aniónico (-). El grupo auxocromo es un anión y va a interaccionar con componentes celulares básicos de la célula, como el citoplasma y estructuras con carga positiva. Ejemplos: eosina, rojo-congo, fucsina, nigrosina.
- Grupo auxocromo básico o catiónico (+). El grupo auxocromo es un catión y va a interaccionar con regiones o zonas ácidas de la célula que tengan carga negativa, como con los ácidos nucleicos. En general todas las bacterias tienen una carga externa negativa: estos colorantes van a interaccionar sobre todo con la pared bacteriana. Ejemplo: safranina, azul de metileno, cristal violeta.
- Grupo auxocromo sin carga, liposoluble. Combinación de un anión y un catión que normalmente en solución para teñir se van a disociar en los dos átomos. Ejemplo: eosina de metileno, negro-sudán.
Fases de la tinción
Comprende varias partes:
- Extensión. Se toma la muestra y se extiende a lo largo del porta.
- Secado breve.
- Fijación. Normalmente se fijan suavemente con una llama, y es una fijación en un doble sentido: una fijación física que consiste en que la capa que hemos puesto quede pegada al cristal y una fijación biológica, de tal manera que cuando se aplica calor se desnaturalizan las estructuras celulares, se coagulan las proteínas en su conformación nativa de manera que ahora puedan tomar el colorante. Solo en algunos casos se puede acudir a una fijación química.
- Aplicación del colorante. Es el proceso de tinción en si mismo.
- Lavado.
- Observación.
Mecanismos de tinción
Fundamentalmente hay dos:
- Tinción por intercambio iónico. Si tenemos una bacteria con carga negativa y le añadimos azul de metileno, el grupo auxocromo desplaza a los cationes adheridos a la pared bacteriana y los sustituyen, liberándose cloruro sódico.
- Tinción por solubilidad diferencial del colorante entre la muestra y el medio. Las células en un medio acuoso tienen estructuras hidrofóbicas en su interior. Si teñimos con negro-sudán (que es lipofílico) no se disuelve en el agua y se une a las regiones hidrofóbicas (o con un alto contenido en lípidos), y así tiñe.
Tipos de tinciones
- Simple. Aplica un único colorante que tiñe completamente las células. Normalmente es con azul de metileno. No es muy útil (se obtiene información sobre la forma y variedad, pero poco mas).
- Diferencial. Incorpora 2 colorantes de forma excluyente (cada bacteria se teñirá con uno de ellos, pero no con los dos). Tinción de GRAM (1884) y tinción de Ziehl-Neelsen (para las bacterias acido-acohol resistentes).
- Específica o selectiva. El colorante se adhiere y tiñe determinadas estructuras especificas de la célula por las que tiene afinidad. Endosporas, volutinas, flagelos. Leifson, con rosanilina (que tiene acido tánico), aumenta la visibilidad del flagelo, que se fija con formol. Como ejemplos tenemos la tinción negativa, la de flagelos, o endosporas.
En el artículo que enlazamos a continuación podrás ver las tinciones y colorantes principales usados en microbiología.
Tinción de Gram
Data del año 1884, por Hans Christian Gram. La preparación consta de varias partes:
- Se prepara el frotis, y se tiñe en primer lugar con cristal violeta (generalmente durante 1min, aunque el tiempo depende de la pureza del colorante). TODAS las células se tiñen de color azul violeta.
- Se añade lugol, que es una solución de Iodo y ioduro potásico que tiene función de mordiente es decir se une con el cristal violeta y forma un complejo insoluble que queda atrapado y absorbido dentro de las células.
- Esta es la etapa crítica: decolorar con alcohol de 96º. Todas las células toman el primer colorante pero cuando le añadimos el alcohol, las GRAM- pierden el colorante, mientras que las GRAM+ siguen coloreadas.
- Ahora añadimos el colorante de contraste, en este caso, la safranina, la cual tiene que tener un grupo cromóforo que no sea violeta, que suele ser rojo rosa. Ahora las GRAM+ se ven color violeta y las GRAM- de color rosa.
Es preferible utilizar cultivos jóvenes, para evitar alteraciones en la pared y por lo tanto, confusiones. Si se abusa del alcohol se puede extraer la tinción de las GRAM+ por lo que hay que tener cuidado.
Para ver la tinción de Gram con más detalle tienes el siguiente artículo donde se analiza la tinción de Gram además de otras tinciones y colorantes usados en microbiología.
¿Alguna vez te has preguntado cómo las bacterias logran mantener su forma y protegerse a sí mismas contra factores externos? La respuesta está en el peptidoglicano, una molécula clave en la estructura de la pared celular de las bacterias.
Este material es tan importante para ellas, que sin él simplemente se desintegrarían. ¿Quieres saber más sobre cómo el peptidoglicano juega un papel crucial en la biología bacteriana? ¡Sigue leyendo para descubrirlo!
Índice de contenidos
Qué es el peptidoglicano
El peptidoglicano es un compuesto exclusivo de bacterias, formado por azúcares y aminoácidos, de ahí su nombre (péptido, uno o más aminoácidos unidos mediante enlaces químicos; glicano, polímero de monosacáridos, o, en otras palabras, conjunto de azúcares simples). No es una proteína.
Es el compuesto cuya función es dar rigidez, consistencia y forma a la pared celular bacteriana. De hecho, si se inhibe su biosíntesis o su degradación especifica durante el crecimiento celular esto acaba provocando la lisis celular; de ahí que muchos antibióticos ataquen estos procesos.
La pared celular es un elemento de suma importancia en la bacteria, ya que resiste la gran presión osmótica interna de la célula, y el peptidoglicano es el elemento clave para sus características. La composición química de esta compuesto es bastante similar en GRAM+ y GRAM-, aunque tienen diferencias que veremos más adelante. De hecho, esas diferencias son las que dividen a las bacterias en estos dos grupos: bacterias gram positivas y gram negativas. El peptidoglicano también se conoce como peptidoglucano o mureína. Es un compuesto que aparece exclusivamente en bacterias; no aparece en organismos eucariotas.
La cubierta de peptidoglicano envuelve a la célula bacteriana, y se encuentra por encima de la membrana celular, pero debajo de la membrana externa en las bacterias que tengan esta estructura (bacterias GRAM negativas).
Composición. ¿De qué está hecho el peptidoglicano?
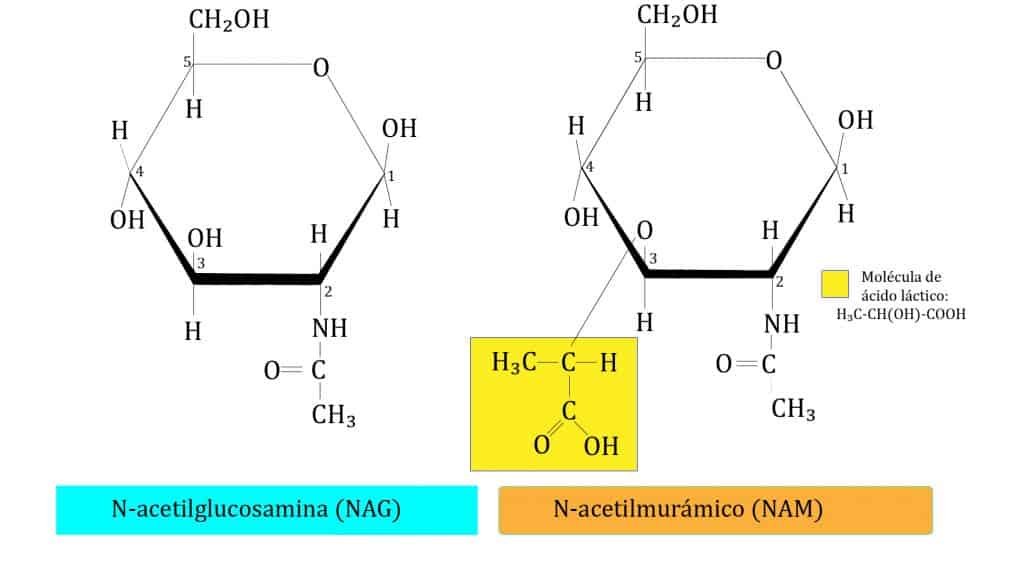
El peptidoglicano está formado por una secuencia alternante de dos azúcares, N-acetil-glucosamina (NAG) y el ácido N-acetilmurámico (NAM), unidos por enlaces β(1→4), entre el C1 de NAM y el C4 de NAG*. NAM es un derivado de NAG al que se le ha añadido una molécula de ácido láctico en el C3. La estructura del peptidoglicano está conformada por tres capas que veremos a continuación.
*En el caso de las arqueas, su pared celular tiene pseudopeptidoglucano formado por N-acetil-glucosamina unida a N-acetiltalosaminomurámico mediante enlaces β(1→3).
La primera capa del peptidoglicano (horizontal) está formada por filas lineales de NAG y NAM unidos de forma secuencial, mediante enlaces covalentes.
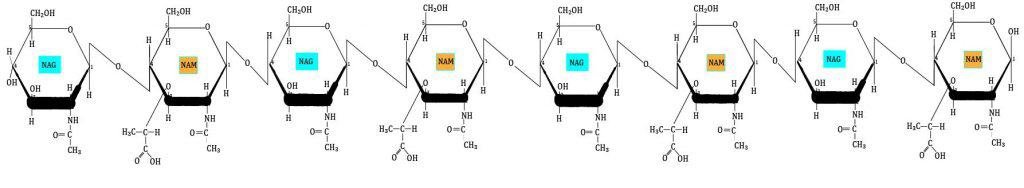
La segunda capa (vertical) está formada por un tetrapéptido unido solamente a NAM (esta es otra diferencia entre NAG y NAM). A este tetrapéptido se le denomina tetrapéptido del glicano. Este tetrapéptido contiene:
- L-alanina
- D-glutámico (en algunas bacterias puede estar hidroxilado)
- L-lisina en la mayoría de GRAM+ o meso-diamino-pimélico (m-DAP) en GRAM- y algunas GRAM+ (en GRAM+ también pueden aparecer otros aminoácidos)
- D-alanina
La formulación de estos aminoácidos unidos a NAM se encuentran en la imagen de abajo.
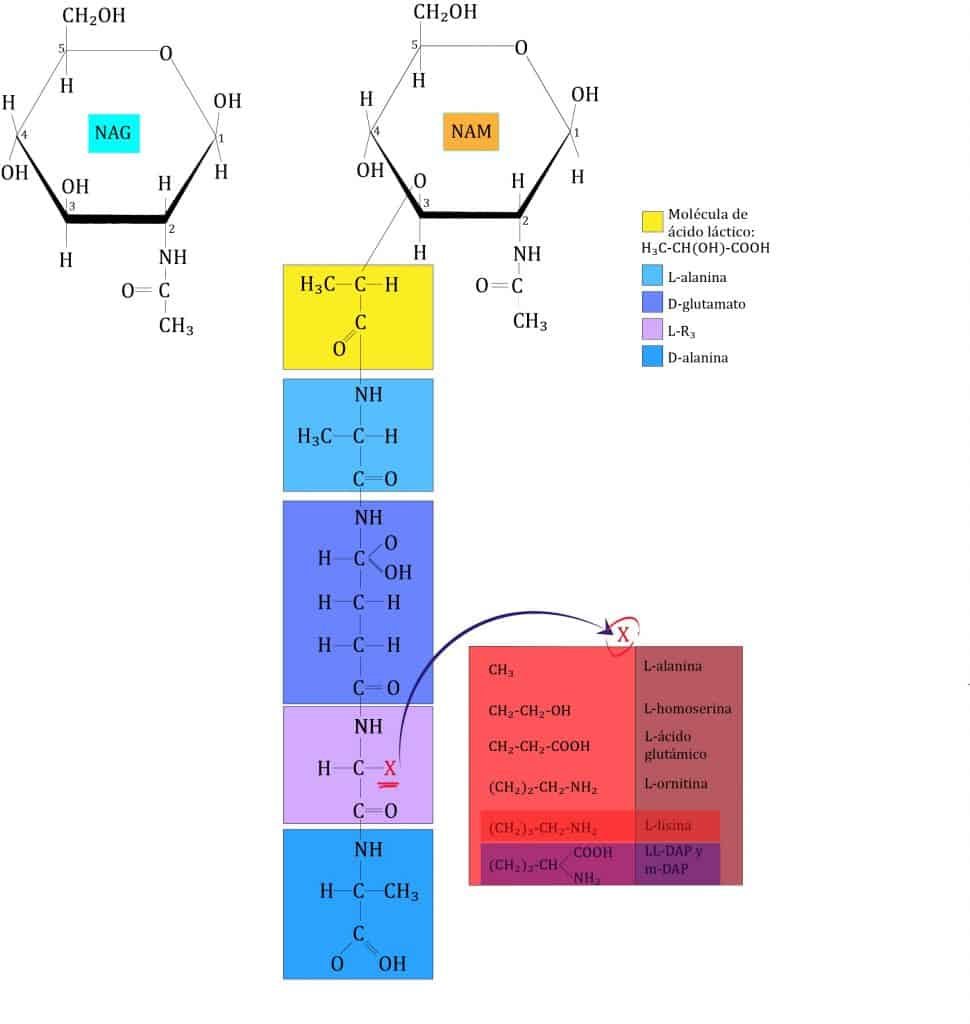
Como se puede ver, aquí aparecen proteínas formadas tanto de d-aminoácidos como de l-aminoácidos, de ahí una de sus particularidades (ya que las células usan solo l-aminoácidos para formar proteínas).
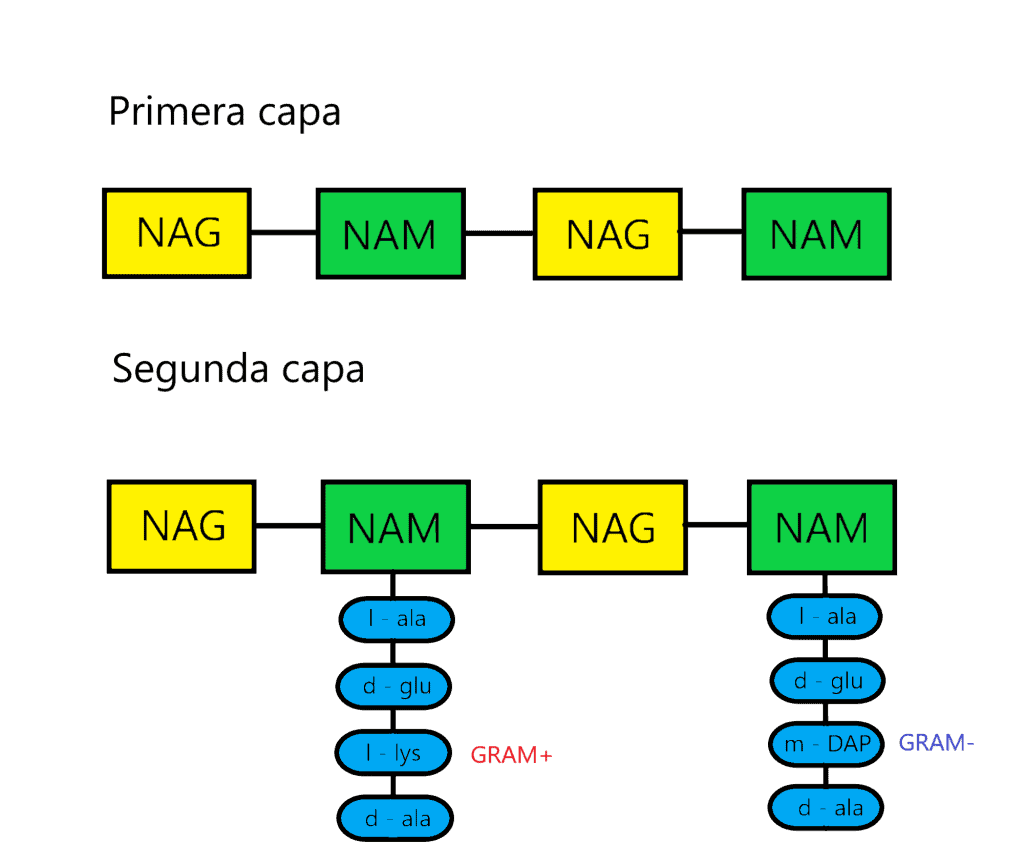
La tercera capa está formada por la unión de dos NAM vecinos. Para ello, la mayoria de veces se forma un enlace peptídico entre el cuarto aminoácido de un tetrapéptido (d-alanina) y el tercero de otro (L-lisina o m-DAP) mediante una reacción de transpeptidación. La composición de estos puentes peptídicos varía entre los diferentes grupos bacterianos; de hecho, los aminoácidos y la posición de este enlace se ha usado para clasificarlos (taxonomía). En bacterias GRAM- y algunas especies de Bacillus el enlace es directo, entre la D-alanina y el ácido diaminopimélico (m-DAP). En la mayoría de bacterias GRAM+ hay un puente formado por uno o más aminoácidos. Ejemplos:
- Staphylococcus aureus. Puente formado por 5 residuos de glicina.
- Micrococcus roseus. Puente formado por 3 L-alaninas y 1 L-treonina.
- Staphylococcus epidermidis. Puente formado por 3 glicinas y 2 L-serinas.
A veces el puente es desde el aminoácido D-alanina terminal hasta el α-carboxilo de ácido D-glutámico del otro tetrapéptido. Debido a que hay una conexión entre 2 grupos carboxilo, es necesario que el puente contenga diaminoácidos.
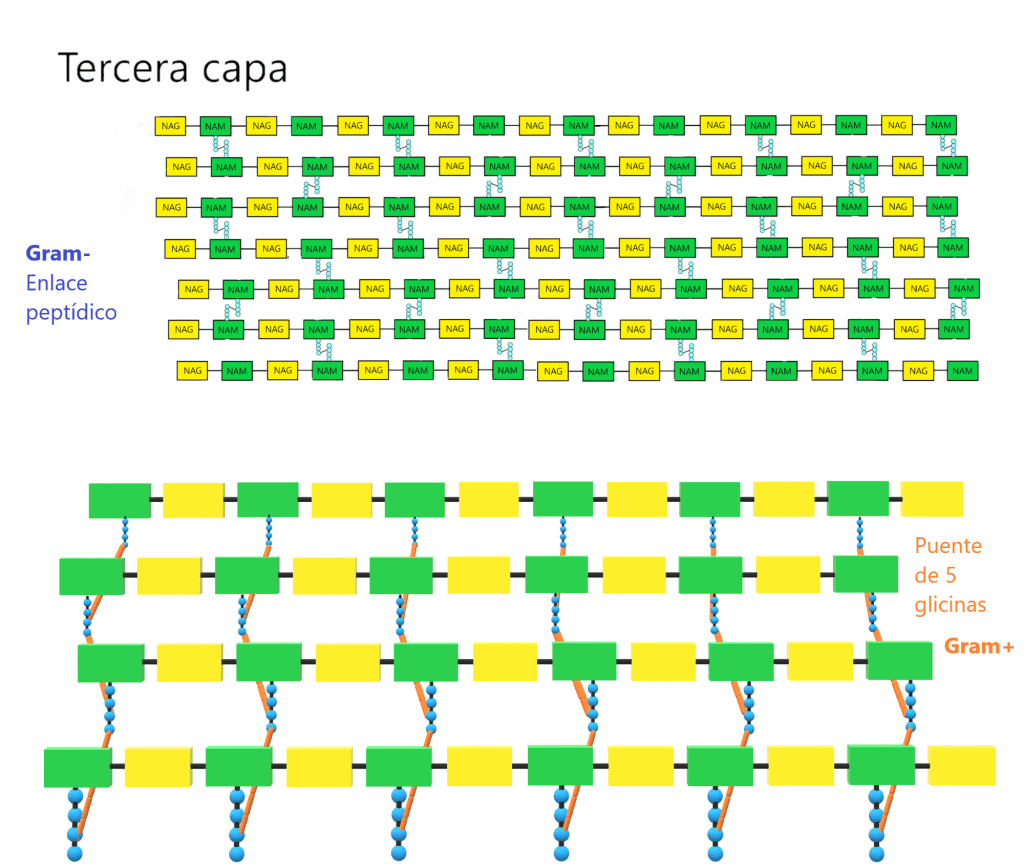
Estas tres capas forman la estructura tridimensional que da rigidez a la pared. Aunque pueden haber variaciones en la parte proteica del peptidoglicano, los enlaces entre NAG y NAM iguales para todas las especies bacterianas. No todos los tetrapéptidos unidos a NAM sufren la reacción de transpeptidación. De hecho, la pared tiene que tener algo de porosidad para permitir el paso de sustancias por la pared. Además, para que la célula pueda replicarse, necesita dividirse, expandirise, y es otra razón por la que la pared debe tener cierta flexibilidad. Ahora bien, cuantos más tetrapéptidos sufren la reacción de transpeptidación, más resistente será la pared celular.
Biosíntesis del peptidoglicano
La síntesis del nuevo peptidoglicano ocurre durante el proceso de crecimiento celular. Hay cuatro fases en este proceso. Primero, se forman los precursores del PG, que son derivados UDP de aminoazúcares formados en el citosol. Después, los aminoazúcares se transfieren a un transportador lipídico de membrana que los lleva a los aminoazúcares a través de la membrana celular. Más adelante, el PG se formará en la superficie externa de la membrana. Por último, ocurrirá la reacción de transpeptidación que forma puentes entre tetrapéptidos de NAM.
Reacciones en el citosol
Los azúcares NAG y NAM son los precursores del PG. Ambos se forman a partir de la fructosa-6-fosfato. Las reacciones se pueden ver en la imagen de abajo. Todo empieza cuando la glutamina da un grupo amino a la fructosa-6-fosfato, que la convierte en glucosamina-6-fosfato (1) Esta reacción esta mediada por la enzima fructosa-6-fosfato aminotransferasa. Más tarde, una transacetilasa (glucosamina fosfato transacetilasa) transfiere un grupo acetilo que proviene del acetil-CoA al grupo amino de la glucosamina-6-fosfato, y forma la N-acetilglucosamina-6-fosfato (2). La N-acetilglucosamina-6-fosfato sufrirá un proceso de isomerización, mediada por la N-acetilglucosamina fosfomutasa que la transformará en N-acetilglucosamina-1-fosfato (3). Este monofosfato ataca a UTP, y desplaza el pirofosfato, cambiando el compuesto a UDP-N-acetilglucosamina (UDP-GlcNAc); reacción en la que interviene la enzima UDP-N-acetilglucosamina fosforilasa (4). A partir de aquí, algunos de los UDP-GlcNAc se usan como precursores de la N-acetilglucosamina, mientras que otros se convierten en ácido UDP-N-acetilmurámico (UDP-MurNAc).
UDP-GlcNAc se covierte en UDP-MurNAc añadiendo un grupo lactilo (5). Durante está reacción, mediada por la enolpiruvato transferasa, el grupo hidroxilo C₃ desplaza un fosfato del carbono α del fosfoenolpiruvato, formando el UDP-N-acetilglucosamina-3-enolpiruvatoéter. Después, el derivado de enol se reduce a una porción de lactilo mediante el NADPH, en una reacción llevada a cabo por la enzima UDP-N-acetilglucosamincenol-piruvato reductasa (6). UDP-MurNAc se acaba convirtiendo en pentapéptido UDP-MurNAc mediante la adición secuenciada de (7):
- L-alanina
- D-glutamato
- L-R₃ (aminoácido de la tercera posición que puede variar en función de la bacteria)
- Dipéptido D-alanil-D-alanina
- ATP
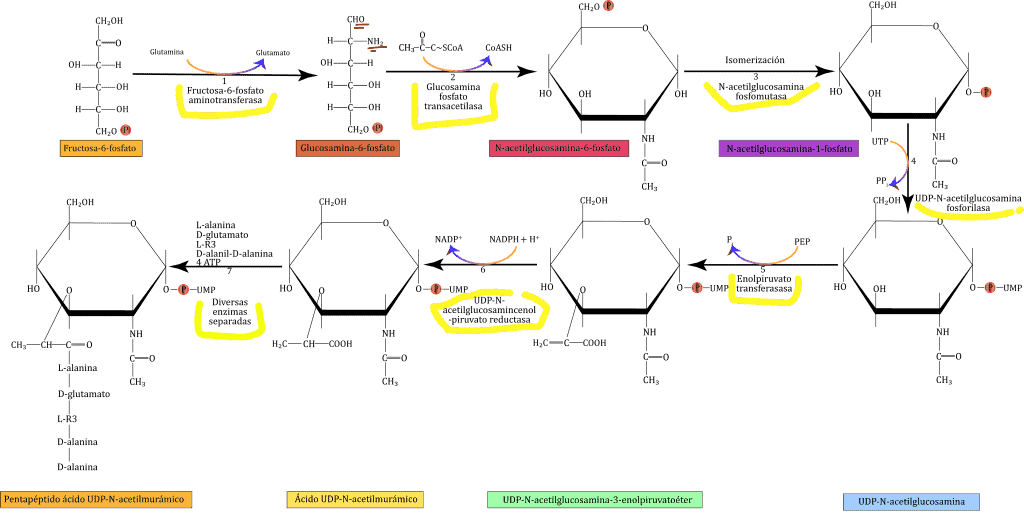
Cada reacción es catalizada por enzimas específicas y requiere ATP para activar el grupo carboxilo del aminoácido. El grupo carboxilo es un acil fosfato, que es atacado por el grupo amino que viene a unirse al aminoácido, desplazando el fosfato. Esta reacción produce ADP y un fosfato inorgánico. El dipéptido D-alanil-D-alanina se forma por la actuación de dos enzimas: la L-alanina-racemasa, que convierte L-alanina en D-alanina; y la D-alanil-D-alanil sintetasa dependiente de ATP, que forma D-alanil-D-alanina a partir de 2 D-alaninas. La quinta D-alanina se extraerá de esta estructura en el proceso de transpeptidación que veremos más adelante. Ambas enzimas, la racemasa y la sintetasa, son inhibidas por el antibiotico D-cicloserina.
Este pentapéptido UDP-MurNAc se transfiere al transportador lipídico en la membrana, y empiezan así los procesos en la membrana celular.
Reacciones en la membrana
El transportador lipídico que al que nos referimos es el bactoprenol (o undecaprenil-fosfato), un isoprenoide fosfato C55 hidrófobo. Además de transportar los precursores del PG, también mueve los precursores de otros polímeros, como el lipopolisacárido (LPS) o los ácidos teicoicos. Los nucleótidos azucarados se mueven por difusión a la superficie citoplasmática de la membrana, y allí el bactoprenol (lípido-P) ataca al pentapéptido UDP-MurNAc, liberando UMP (1). El producto es el pentapéptido lípido-PP-MurNac. GlcNAc se transfiere del UDP-GlcNAc a MurNAc en el transportador lipídico cuando el C4 hidroxilo en MurNAc ataca el carbono C1 en UDP-GlcNAc, liberando UDP (2). El compuesto resultante es el disacárido precursor del PG, pentapéptido lipido-PP-MurNAc-GlcNAc. Este compuesto se moverá al otro lado de la membrana (3). Si bien no se sabe exactamente como se mueve a través de la membrana, parece ser que es ayudado por proteínas aun por identificar.
Las proteínas fijadoras de penicilina (PBP), o autolisinas, estarán envueltas en los procesos de transglicosilación, transpeptidación y carboxipeptidación. En el lado externo de la membrana, este compuesto es transferido al glicano en formación y se sitúa en la parte final de la cadena. Esta reacción es una transglicosilación en la cual el C4 hidroxilo de GlcNAc en formación ataca el C1 de MurNAc del glicano, desplazando el bactoprenol de la cadena de glicano que se está formando (4,5). Esta reacción es catalizada por una enzima transglicosilasa ligada a la membrana (PBP-1a y PBP-1b).
No obstante, la cadena de glicano en formación sigue anclada a la membrana por el carrier lipídico en el sitio de la transglicosilasa. El lípido-PP formado por la cadena en formación se hidroliza por una pirofosfatasa ligada a la membrana, que forma lípido-P y libera un fosfato (6). Esta reacción es de suma importancia, ya que finaliza la reacción de transglicosilación, debido a que la hidrólisis del fosfodiester libera energía (el fosfato). Además, así se vuelve a formar el lípido-P (bactoprenol) que se puede reutilizar para la formación de PG u otros polímeros (7). Esta hidrólisis es inhibida por el antibiótico bacitracina.

El proceso de síntesis de peptidoglicano debe estar perfectamente coordinado. Los nuevos tetrapéptidos se deben unir al PG existente justo después de que las autolisinas actúen. Sino, se formaría una brecha en la integridad del PG en el punto de empalme, que podría desembocar en la lisis espontánea de la bacteria (autolisis).
Cross-linking. Transpeptidación
Para formar los puentes peptídicos entre los tetrapéptidos de NAM de cadenas adyacentes y así unir a los péptidos (cross-linking) hace falta energía. La transpeptidación es el proceso por el cual se obtiene energía necesaria para unir a los péptidos. En el peptidoglicano maduro, un grupo NH₂ del diaminoácido de la tercera posición (por ejemplo, el diamino-pimélico) ataca el carbonilo (C=O), desplazando el aminoácido D-alanina terminal (hidrolización). Este proceso está mediado por transpeptidasas (PBP-1a y PBP-1b). Los residuos D-alanina terminales que no participan en estas uniones también se eliminan, pero este proceso lo lleva a cabo la carboxipeptidasa D-alanina (PBP-4, PBP-5 y PBP-6). Diversos antibióticos, como la penicilina, inhiben esta reacción.
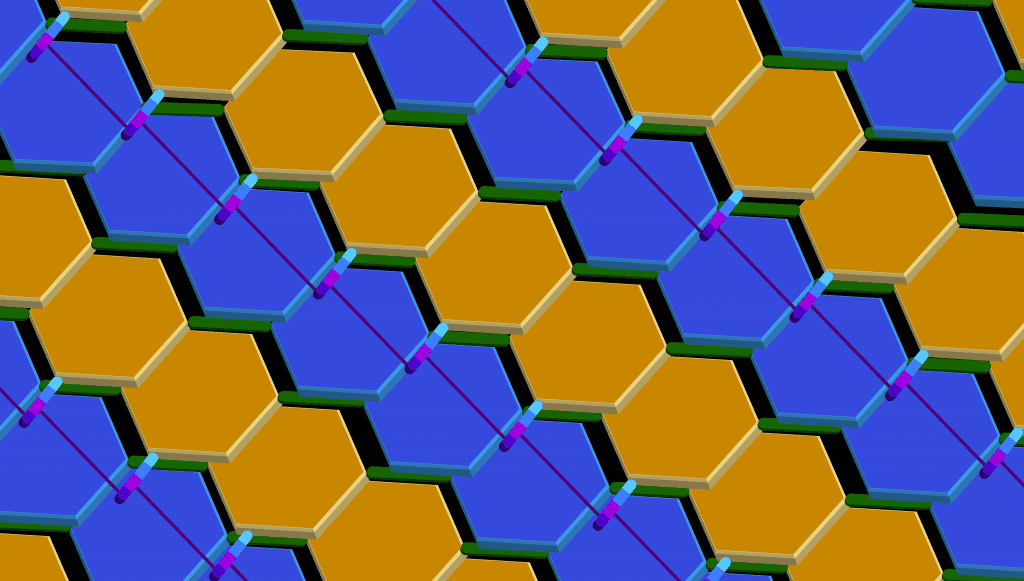
Azul: NAG
Naranja: NAM
Verde: enlaces β(1→4), entre el C1 de NAM y el C4 de NAG
Violeta: Enlace entre dos NAM de distintas líneas.
Los antibióticos y el peptidoglicano. ¿Qué ocurre si no se produce peptidoglicano?
Como ya hemos comentado, la pared celular tiene muchas funciones, y una de ellas es resistir la presión osmótica interna de la bacteria. El peptidoglicano es de suma importancia para que la pared celular tenga las propiedades que necesita la bacteria. De hecho, si se inhibe la biosíntesis del peptidoglicano o su degradación especifica durante el crecimiento celular esto acabará desembocando en la lisis de la célula (destrucción de la célula). Por ese motivo, usamos diversos antibióticos que atacan dichos procesos. Veamos varios antibióticos que se usan para el tratamiento antimicrobiano:
- Fosfomicina. Derivado del ácido fosfórico que inhibe la actuación de la enzima enolpiruvato transferasa, ya que es análogo del fosfoenolenilpiruvaoto (PEP). Es sintetizada por Streptomyces fradiae.
- D-cicloserina. Análogo de D-alanina que inhibe la conversión de L-alanina en D-alanina llevada a cabo por la enzima racemasa. Sintetizada por Streptomyces archidaceus.
- Bacitracina. Se une al bactoprenol fosforilado, e impide su desfosforilación. De esta forma se evita su reutilización para la formación de PG. Es sintetizado por Bacillus licheniformis y Bacillus subtilis. Se usa contra bacterias GRAM+.
- Vancomicina. Se une el dipéptido D-alanil-D-alanina (2 residuos de D-alanina) mediante puentes de hidrógeno. De esta forma se evita la reacción de transglicosilación que une el glicano en formación al peptidoglicano ya existente. Sintetizada por Streptomyces orientalis.
- Mureidomicinas. Se unen al bactoprenol ya que son análogos del pentapéptido UDP-MurNAc, evitando así su tranporte a la membrana plasmática. Son sintetizadas por Streptomyces flavidivirens.
- β-lactámicos. Bloquean la actividad transpeptidasa de las proteínas fijadoras de penicilina (PBP) relacionadas con las reacciones de transglicosilación, transpeptidación y carboxipeptidación. De esta forma, la formación de PG disminuye, lo que desemboca en la muerte de la bacteria, sea por no aguantar la presión osmótica o por enzimas autolíticas.
- Penicilinas. Sintentizadas por el hongo Penicillium. Clasificación:
- Penicilinas naturales. Penicilina G, Penicilina V. Se usan contra cocos GRAM+.
- Resistentes a penicilinasas. Oxalicina, meticilina, cloxacilina. Se usa contra GRAM+, destacando a Stafilococcus aureus productor de β-lactamasa.
- De amplio espectro. Ampicilina, amoxicilina, amoxicilina con ácido clavulánico. Se usa frente a cocos GRAM+ y algunas GRAM-.
- Anti-pseudomonas. Carbenicilina, piperacilina/tazobactam. Se usa contra Pseudomonas aeruginosa y bacterias GRAM- que aparecen en hospitales.
- Cefalosporinas. Sintetizadas por Cephalosporium. Tienen un espectro más amplio que las penicilinas. Hay 4 grupos:
- 1ª generación. Ejemplo: Cefalotina. Se usan especialmente contra GRAM+.
- 2ª generación. Ejemplo: Cefoxitina. Se usa frente a muchos organismos GRAM- y algunos GRAM+.
- 3ª generación. Ejemplo: Cefoperazona. Son más eficaces contra bacterias GRAM-.
- 4ª generación. Ejemplo: Cefepime. Espectro muy amplio.
- Penicilinas. Sintentizadas por el hongo Penicillium. Clasificación:
Diferencias entre GRAM positivas y GRAM negativas
El peptidoglicano, si bien es un compuesto común de las bacterias, tiene diferencias entre organismos GRAM+ y GRAM-, como los que veremos a continuación (en la tabla final se puede ver un resumen de estas).
En bacterias GRAM+, el peptidoglicano ocupa hasta el 90% de la pared celular. Pueden aparecer bacterias con solo una capa de peptidoglicano rodeando a la célula, pero la mayoría de bacterias cuenta con muchas láminas apiladas unas sobre otras. Eso sí, la capa se sitúa en el exterior de la membrana plasmática. En la tinción de Gram, dentro de las células se forma un complejo cristal violeta-yodo que NO puede extraerse. Y es debido a sus gruesa pared celular formada por varias capas de peptidoglicano. Al introducir alcohol, se deshidratan, lo que provoca el cierre de los poros de las paredes, así que el colorante no sale de la bacteria. Además, en bacterias GRAM+ aparecen los llamados ácidos teicoicos. Son polímeros de la pared que contienen unidades de glicerolfosfato o de ribitolfosfato. También pueden tener unidos otros azúcares y d-alanina. Los ácidos teicoicos se unen mediante enlace covalente a residuos de NAM. Pueden intervenir uniendo calcio (Ca2+) y magnesio (Mg2+) para su transporte. Tienen carga negativa, así que tienen su parte de responsabilidad de la carga negativa de la superficie celular.
En bacterias GRAM-, el peptidoglicano ocupa hasta el 10% de la pared celular. Está situada entre la membrana externa y la membrana interna de la célula. La mayor parte de la pared celular está formada por la membrana externa, una segunda bicapa lipídica que, aparte de fosfolípidos y proteínas, también contiene polisacáridos. A esta membrana se le llama lipopolisacárido (LPS). En la tinción de Gram, dentro de las células se forma un complejo cristal violeta-yodo que puede extraerse. Y es debido a que la membrana externa es rica en lípidos, además de que la capa de peptidoglicano es tan fina que no impide el paso del solvente, así que el colorante sale de la célula. Después del tratamiento con alcohol, estas bacterias reciben una tinción de contraste, la safranina, para diferenciarse de las bacterias GRAM+.
| Diferencias entre bacterias GRAM+ y GRAM- | ||
|---|---|---|
| Bacterias | GRAM+ | GRAM- |
| Tamaño de PG | Hasta 90% de la pared celular | Hasta el 10% de la pared celular |
| Localización del PG | Al exterior de la membrana plasmática | Entre la mebrana interna y la membrana externa |
| Tinción de GRAM | Complejo cristal violeta-yodo | Safranina |
| Color en la tinción de GRAM | Azul, violeta | Rojo, rosa, naranja |
| Tercer aminoácido del tetrapéptido | L-lisina normalmente; mucha variación de aminoácidos | m-DAP casi siempre; poca variación de aminoácidos |
| Transpeptidación (cross-linking) | Casi siempre puente de aminoácidos | Casi siempre enlace directo |
| Compuestos unidos a PG | Ácidos teicoicos | Lipopolisacárido (LPS) |
Pseudopeptidoglicano: estructura y función
¿Qué se entiende por pseudopeptidoglicano?
El pseudopeptidoglicano, también conocido como pseudomureína, es uno de los principales componentes de la pared celular de ciertas arqueas metanogénicas. Aunque su estructura química es diferente a la del peptidoglicano de las bacterias, ambos cumplen funciones similares en la protección y rigidez de la célula.
Estructura del pseudopeptidoglicano
A nivel estructural, el pseudopeptidoglicano está compuesto por dos azúcares: N-acetilglucosamina (NAG) y ácido N-acetiltalosaminurónico (NAT). Esta diferencia clave con el peptidoglicano bacteriano, que contiene ácido N-acetilmurámico (NAM) en lugar de NAT, se refleja también en los enlaces que forman la cadena. En el pseudopeptidoglicano, los azúcares están unidos por enlaces β-1,3-glicosídicos, a diferencia de los β-1,4-glicosídicos presentes en el peptidoglicano.
Esta estructura única hace que el pseudopeptidoglicano sea resistente a la lisozima, una enzima presente en las secreciones humanas como saliva y lágrimas, que descompone el peptidoglicano bacteriano al romper los enlaces β-1,4. Al no poder actuar sobre los enlaces β-1,3 del pseudopeptidoglicano, la lisozima se vuelve ineficaz frente a las arqueas que poseen este polímero en sus paredes celulares.
Diferencias con el peptidoglicano
Existen varias diferencias importantes entre el peptidoglicano bacteriano y el pseudopeptidoglicano de las arqueas:
- Composición química: Mientras que el peptidoglicano contiene N-acetilglucosamina y ácido N-acetilmurámico, el pseudopeptidoglicano contiene N-acetilglucosamina y ácido N-acetiltalosaminurónico.
- Enlaces glicosídicos: Los enlaces entre los azúcares en el peptidoglicano son de tipo β-1,4, mientras que en el pseudopeptidoglicano son de tipo β-1,3, lo que confiere una mayor resistencia a ciertas enzimas degradativas.
- Distribución: El peptidoglicano se encuentra en la mayoría de las bacterias, mientras que el pseudopeptidoglicano es exclusivo de algunas arqueas metanogénicas.
Función del pseudopeptidoglicano
Al igual que el peptidoglicano en las bacterias, el pseudopeptidoglicano en las arqueas tiene la función de proporcionar rigidez estructural y protección frente a condiciones externas adversas. Actúa como una barrera, ayudando a las células a mantener su forma y protegiéndolas de factores ambientales perjudiciales.
Además, debido a su composición única, es resistente a ciertos antibióticos que atacan la pared celular bacteriana, como la penicilina, que resulta ineficaz contra el pseudopeptidoglicano debido a las diferencias en las enzimas implicadas en la reticulación de los aminoazúcares.
Evolución del pseudopeptidoglicano
El pseudopeptidoglicano ofrece una ventana a las estrategias evolutivas de las arqueas frente a las bacterias. Su resistencia a enzimas bacterianas, como la lisozima, y su insensibilidad a ciertos antibióticos demuestran cómo las arqueas han desarrollado adaptaciones únicas para sobrevivir en ambientes extremos.
Estas características podrían haber sido moldeadas por las presiones evolutivas en entornos inhóspitos, como los océanos profundos o los hábitats metanogénicos, donde las arqueas prosperan.
Referencias
Calvo. J, Martínez-Martínez. L, Mecanismos de acción de los antimicrobianos. (2009) Enfermedades Infecciosas y Microbiología Clínica, Volume 27, Issue 1, Pages 44-52, ISSN 0213-005X. DOI: 10.1016/j.eimc.2008.11.001.
Mensa. J, Gatel. J. M, García-Sanchez. J. E, Letang. E, López-Suñe. E, Marco. F. (2018) Guia de terapeútica antimicrobiana 2018, Editorial: Antares, Nº de edición: 28ª, ISBN-13: 9788488825247
Mechthild Pohlschroder, Friedhelm Pfeiffer, Stefan Schulze, Mohd Farid Abdul Halim, Archaeal cell surface biogenesis, FEMS Microbiology Reviews, Volume 42, Issue 5, September 2018, Pages 694–717, https://doi.org/10.1093/femsre/fuy027
Michael T. Madigan. (2015) Brock: biología de los microorganismos. Edición 14. Pearson Educación. ISBN: 8490352798, 9788490352793
Vollmer, W., & Höltje, J. V. (2000). A simple screen for murein transglycosylase inhibitors. Antimicrobial agents and chemotherapy, 44(5), 1181–1185. https://doi.org/10.1128/aac.44.5.1181-1185.2000
Vollmer W, Blanot D, de Pedro MA. (2008) Peptidoglycan structure and architecture. FEMS Microbiol Rev. 2008;32(2):149‐167. doi:10.1111/j.1574-6976.2007.00094.x
White, D., Drummond, J., & Fuqua, C. (2012). The physiology and biochemistry of prokaryotes. New York: Oxford University Press.
