En el último apartado de proteobacterias veremos a otras proteobacterias que no entran en ninguno de los grupos anteriores, a saber: proteobacterias con morfología inusual (espirilos, bacterias con vaina), pedunculadas, mixobacterias deslizantes, bacterias reductoras de sulfato del sulfato y azufre, y proteobacterias del grupo épsilon.
Índice de contenidos
Proteobacterias con morfología inusual: espirilos
Helicoidales
Dentro de las helicoidales entran Spirillum, Aquaspirillum, Oceanospirillum, Magnetospirillum o Azospirillum.
Todas cuentan con típica morfología helicoidal (forman más de una vuelta de hélice). Son móviles mediante flagelos polares generalmente en número superior a dos (pueden presentar penachos, flagelacion lofótrica) en ambos polos celulares. Tienden a ser microaerófilos. Son de gran tamaño en general. Hay especies acuáticas y terrestres. La mayoría son acuáticas e inofensivas como Spirillum (prototipo de este grupo).

Spirillum volutans
Es muy grande, de 1'6 x60 μm; se supone que podría ser el microorganismo que describió Leeuwenhoeck, el padre de la microbiología. Es microaerófilo, con flagelación lofótrica en ambos extremos. Tiene una acumulación de gránulos de volutina. Es un organismo acuático.
Aquaspirillum
Es aerobio o microaerófilo. Flagelación lofótrica en ambos extremos. Vive en agua dulce.
Oceanospirillum
Habita en agua salada, por lo que para poder cultivarlo debemos añadir NaCl al medio de cultivo. Es aerobio.
Magnetospirillum (M. magnetotacticum)
Es capaz de responder a campos magnéticos. Es un microorganismo magnetotáctico. Posee partículas de magnetita (entre 5-40), que se disponen unidas en cadena y le sirven para alinearse según las líneas geomagnéticas. En el hemisferio norte se mueven en dirección norte y en el hemisferio sur se mueven en dirección sur. Esta característica puede ser una ventaja evolutiva para mantener estos microorganismos microaerófilos en zonas de baja concentración de oxígeno, cerca de la interfase aerobia-anaerobia (interfase óxica-anóxica).
Azospirillum
Vive en suelos (fundamentalmente en rizosfera). La especie A. lipoferum es de las más estudiadas. Es microaerófila y fija nitrógeno en simbiosis con ciertas plantas tropicales o de climas templados, como cereales. Su asociación con el maíz beneficia a la planta gracias a la fijación del nitrógeno, favoreciendo su crecimiento.
Todos estos organismos forman más de una vuelta completa de la hélice.
Vibrioides
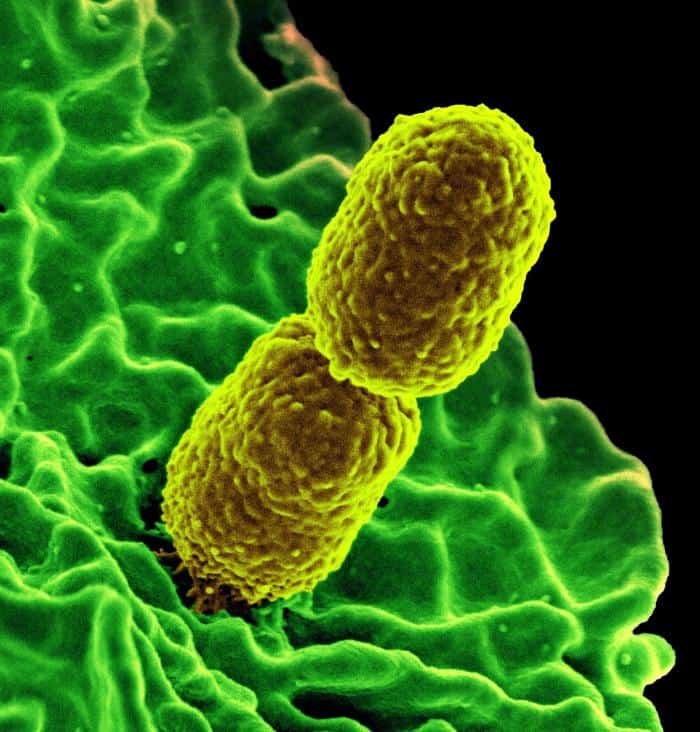
No forman una vuelta completa de hélice. El ejemplo más característico es Bdellovibrio. Es una δ-proteobacteria. El término Bdellovibrio viene del griego “bdella” que significa sanguijuela. Tiene forma de coma, posee un flagelo envainado (vaina=prolongación de la pared celular), lo que facilita su observación, y es de pequeño tamaño.
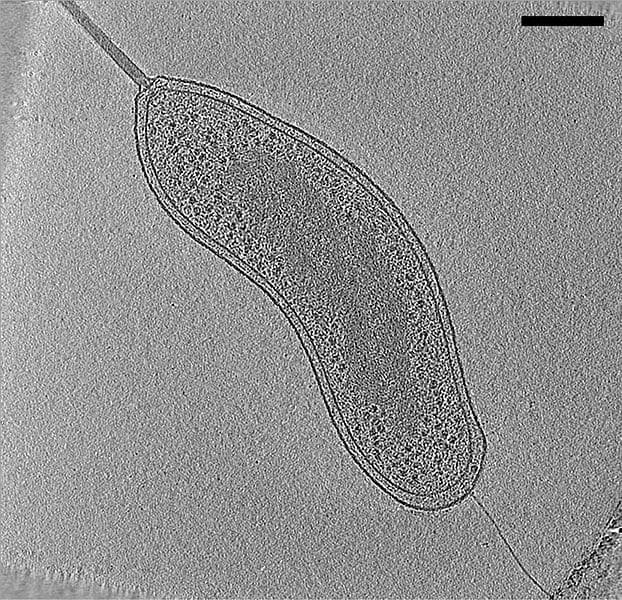
Están presentes en suelos y aguas. Se caracterizan porque depredan a otras bacterias, fundamentalmente GRAM negativas (-).
Bdellovibrio (B. bacteriovorus)
La especie mejor conocida es Bdellovibrio bacteriovorus, la cual tiene un estilo de vida muy característico que alterna dos fases es un ciclo de vida: una fase depredadora extracelular en la que no crece y una fase reproductora intracelular en la que si se divide:
Metabolismo
- Fase extracelular. Es capaz de moverse rápidamente, nada a gran velocidad (10 veces más rápido que otra bacteria móvil), del orden de 70 a 100 veces su longitud por segundo. En principio nada sin dirección preestablecida hasta que resulta atraído por quimiotaxis hasta la presa. Choca con ésta y las dos células unidas giran rápidamente a unas 100 revoluciones por segundo (rps).
- Fase intracelular. Al chocar es capaz de atravesar la pared celular y modificar la membrana externa por la acción de una serie de enzimas hidrolíticos, se desprende del flagelo y taladra la pared celular. Se acomoda en el espacio periplásmico y constituye una estructura esférica más o menos, denominada bdelloplasto. Tarda del orden de 15 a 20 min en acomodarse. Desde esta forma se nutre de todos los componentes de la presa. Inhibe todos los procesos de la otra célula, rompe la membrana citoplasmática y las macromoléculas salen al espacio periplásmico.
Es aerobia estricta y respira aminoácidos y acetato. Es capaz de tomar proteínas enteras, ácidos grasos, aminoácidos y demás. De esta manera economiza tanto carbono como energía, ya que lo toma directamente de la presa. A medida que va biosintetizando se va alargando y finalmente se fragmenta, en tantos fragmentos dependiendo del tamaño de la presa, en E.coli de 5 a 6 Bdellovibrios, en Spirillum de 20 a 30. Una vez fragmentado sintetizan el flagelo y se liberan rompiendo la pared celular de la presa para volver a iniciar el ciclo. Se alejan a gran velocidad. El ciclo puede durar de 2.5 a 4 horas.
Son auténticos depredadores bacterianos. Se supone que Bdellovibrio, junto con protozoos y los fagos, constituyen un modo de control del crecimiento de las poblaciones bacterianas en algunos ambientes.
El modo de ataque y el desarrollo puede clasificarse como único, aunque no es la única bacteria depredadora. Vampirovibrio también se la puede considerar depredadora, en este caso la presa es un alga eucariota, Chlorella, y no pasa al interior del alga, desde fuera la depreda (le 'chupa' su contenido). Posee flagelo, pero no envainado.
Detección y aislamiento
La detección y aislamiento de Bdellovibrio se asemeja bastante a la de los fagos. Se hace crecer la presa en placa y se inocula una suspensión de Bdellovibrio filtrada; donde caiga en la placa forma unas calvas en el césped bacteriano. Estos halos generados se diferencian de los halos de los fagos, pues éstos pueden continuar aumentando de tamaño incluso después de que la presa deje de crecer, pudiendo llegar a ocupar casi toda la superficie de la placa. En el caso de los fagos no aumentan de tamaño las calvas. De estos halos se pueden obtener cultivos puros de Bdellovibrio.
No llegan a formar una colonia típica, sino que están en continuo movimiento. Se aprecia una ligera turbidez, pero no colonias en sí. Pude sufrir ataques por fagos, concretamente bdellofagos, virus líticos y de ADN de una cadena.
Proteobacterias con morfología inusual: bacterias con vaina
Son β-proteobacterias y tienen un ciclo de vida especial en el cual hay dos etapas. Pasan de formas envainadas (en zonas ricas en nutrientes) a formas nadadoras sin vaina en busca de nuevos entornos, dejando las vainas abandonadas. Cuando están en forma nadadora desarrollan flagelación lofótrica. Las vainas están constituidas por proteínas y polisacáridos, pero no por peptidoglicano.

En condiciones de crecimiento desfavorable, están en forma de célula nadadora por la presencia de flagelos lofotricos en posición subterminal. Se dispersan en busca de nuevos entornos donde crecer. Cuando las condiciones son favorables, las células pierden el flagelo y crecen vegetativamente dentro de las vainas. Son bacterias aerobias y se encuentran cerca de la interfase óxica-anóxica.
Viven en la interfase en aguas ricas en materia orgánica como cursos de agua contaminados, en plantas de tratamiento de agua residual. Son quimioheterótrofas; al inicio de su estudio se creyó que eran quimiolitótrofas, pero no acoplan reacciones redox de compuestos inorgánicos para obtener energía. Llevan a cabo reacciones catalizadas por proteínas de la vaina que conducen a depósito de óxidos metálicos por encima o por dentro de la vaina en ambientes con hierro o manganeso en forma reducida. El agua anóxica con estos compuestos alcanza a la zona óxica y las vainas pueden acabar recubiertas por hidróxidos u óxidos de hierro o de manganeso, debido a la capacidad de oxidar estos iones. Pero no son quimiolitótrofas por que no acoplan estos procesos de oxidación de compuestos inorgánicos a la obtención de energía.
Sphaerotilus
Vive en aguas muy polucionadas y no puede oxidar manganeso. Junto con Beggiatoa es responsable del engrosamiento en plantas de tratamiento de agua residual ya que incrementan la masa del fango impidiendo que estas aguas sean tratadas correctamente.
Leptothrix
Vive en agua dulce rica en sales minerales, pero no contaminada. Suele vivir con concentraciones altas de hierro soluble, aunque también puede oxidar el manganeso.
Proteobacterias pedunculadas
Muchas son α-proteobacterias, pero no todas. Se denominan así porque todas tienen algún tipo de apéndice o pedúnculo. Se denomina prostecas a las extrusiones de diámetro menos a la célula madura y que contienen citoplasma y está unida por la pared celular. Cuando el pedúnculo no es celular se denomina tallo, como en Galionella. Hay pedunculadas gemantes y no gemantes.
Gemantes
Hyphomicrobium
Se divide por gemación en el extremo de la prosteca, que tiene forma de hifa. Se denomina hifa cuando se trata de una prosteca reproductora. La yema se agranda, forma un flagelo y se libera de la célula madre y se aleja nadando. Después pierde el flagelo, deja de ser nadadora y tras un periodo de maduración forma la prosteca. En ocasiones se pueden formar varias yemas en el extremo de la hifa madre. Puede haber grupos de células conectados por hifas.

Tiene un ciclo de vida con división desigual, con dos tipos de células: una prostecada y otra nadadora.
Es quimioheterótrofa y está muy cerca filogenéticamente de Rhodomicrobium (es una bacteria roja no del azufre). Además, es metilótrofa y desnitrificante. Habita comúnmente en suelos, también presente en agua dulce y marina. Para cultivarla sería preciso un medio con compuestos C1 y nitrato, y puede crecer en medios con muy baja concentración de nutrientes.
No gemantes
Su pedúnculo puede tener función de adherencia, favorecimiento de la absorción de nutrientes (mayor relación sup/vol): es una adaptación evolutiva para los ambientes oligotróficos. Suele vivir en ambientes oligotróficos, como el anterior. También le sirve para reducir la velocidad de sedimentación, ya que al ser aerobios estrictos las prostecas pueden evitar el hundimiento de las células hacia el fondo (zonas anóxicas), donde morirían.
Caulobacter
Es quimioheterótrofa. Se encuentra a menudo en la superficie de ambientes acuáticos con los pedúnculos de varias células hundidas para formar una especie de roseta. En el extremo poseen un botón de anclaje formado por un material adhesivo secretado desde el extremo de la prosteca, lo que permite su unión a otra superficie (sustrato, pared celular, otra bacteria...).
Presenta ciclo vital con división desigual: da lugar a una célula prostecada inmóvil y una nadadora sin prosteca. En este caso, la prostecada se va a dividir y va a dar lugar a células nadadoras flageladas que se alejan de la célula madre. La formación de la prosteca es precursora de la división celular (para que se pueda dividir es necesaria la prosteca). Los tamaños de prosteca varían dependiendo de las condiciones ambientales.

Gallionella
Posee una morfología vibrioide. Es quimiolitoautótrofa. Presenta tallo, es decir, un pedúnculo sin citoplasma. Presenta incrustaciones de hidróxido férrico coloidal que es excretado desde la superficie en forma de filamentos. Obtiene la energía de la oxidación de hierro y manganeso, y fijan CO2 por el ciclo de Calvin. Viven en ambientes con abundante ion ferroso y oxígeno, asociados a las bacterias envainadas, a pH neutro. Viven en la interfase por la inestabilidad del ion ferroso a pH neutro y en presencia de oxígeno.

Mixobacterias deslizantes
Son δ-proteobacterias quimioheterótrofas. Respecto a su ecología, podemos decir que son socialmente activos, interaccionan para formar masas celulares visibles sin la ayuda del microscopio. Además, son terrestres y han sido aisladas del suelo en todo el mundo, desde bosques tropicales hasta la tundra ártica.
Respecto a su morfología, podemos decir que son deslizantes, suelen ser bacilos largos e incluso filamentosos que no presentan flagelos, pero pueden moverse por deslizamiento cuando están en contacto con alguna superficie. Son fructificantes, forman cuerpos fructíferos: estructuras multicelulares complejas que implican comunicación intercelular.
Muestran el ciclo de vida y patrones de comportamiento más complejos de todos los procariotas conocidos. Para ser capaz de codificar esta complejidad, su genoma es muy grande. Myxococcus xanthus posee un genoma que supone 2/3 el tamaño del genoma de una levadura como Saccharomyces.

Ciclo vegetativo
En forma vegetativa son bacilos bastante largos y flexibles que se deslizan sobre distintas superficies dejando un rastro mucoide, de limo. Consiguen los nutrientes lisando otras bacterias. Mientras las condiciones ambientales sean favorables podrán mantener este ciclo, dividiéndose por fisión binaria.
En superficies sólidas se puede observar la formación de colonias con crecimiento radiante, planas con bordes irregulares que se van extendiendo. Visto al microscopio se puede apreciar el rastro mucoide. Avanzan en pequeños grupos de células de forma coordinada, de modo que esto confiere coherencia entre todos los miembros de la colonia, las células pueden seguirles el rastro: unas van avanzando y otras van siguiendo ese rastro y agrupándose. Suelen ser colonias coloreadas por la presencia de pigmentos de tipo carotenoide (carotenoides glucosídicos). La luz estimula la formación de los pigmentos carotenoides y una de sus funciones es la fotoprotección.
Proceso de esporulación
Se inicia cuando se agota su aporte de nutrientes. Las células se van agregando y experimentan un proceso de diferenciación formando finalmente el cuerpo fructífero. Es un proceso de desarrollo complejo desencadenado por la inanición y muy controlado por ciertas señales. Este cuerpo fructífero a veces es pedunculado, se distinguen tallo y cabeza.
La mayoría, en el caso de tener cabeza y tallo, la mayoría de las células se acumulan en la cabeza y se transforman en mixosporas. En cada cuerpo puede haber del orden de 109 mixosporas. La transformación de células vegetativas a esporas se denomina maduración. Son en realidad exosporas contenidas en el cuerpo fructífero, que como tales resisten ciertas condiciones adversas como la desecación, radiación ultravioleta, sonicación, privación de nutrientes. No resisten tan bien el calor como endosporas. La morfología, tamaño de mixospora, color, varía dentro de cada género y de cada especie.
En algunos géneros existen los microcistos, que son mixosporas capsuladas. En otros pueden ser cistos, que son varias mixosporas encerradas en una estructura de pared.
Si las mixosporas entran en contacto con nutrientes, germinan, forman células vegetativas que se deslizan y forman colonias. Son todas quimioheterótrofas aerobias con metabolismo respiratorio. La mayoría puede usar aminoácidos como fuente principal de carbono, nitrógeno, energía y fuente de poder reductor.
Poseen enzimas hidrolíticos que rompen la pared de las otras bacterias para liberar los nutrientes. Absorven los productos solubles de esa lisis, sobre todo péptidos pequeños. Se piensa que la organización en cuerpos fructíferos puede ser ventajosa ya que la masa de células es capaz de producir mayor cantidad de enzimas para digerir a la presa más fácilmente de lo que lo puede hacer la célula individual.
Las células vegetativas pueden convertirse directamente a mixosporas por ciertos inductores químicos, como una elevada concentración de glicina.
Clasificación
Se clasifican por funciones o características morfológicas (de la célula vegetativa, mixospora, cuerpo fructífero). La forma de las células vegetativas distingue dos bloques. Las familias Myxococcaceae, Archangiaceae y Cystobacteraceae poseen extremos fusiformes, los miembros de la familia Polyangiaceae poseen extremos redondeados. Stigmatella posee pedúnculo en el cuerpo fructífero y un tallo ramificado. Nannocystis carece de los carotenoides típicos de las mixobacterias. Es una de las bacterias más frecuentes en el suelo. Produce, como muchos actinomicetos, geosminas. Es celulolítico y agarolítico (degrada celulosa y agar).
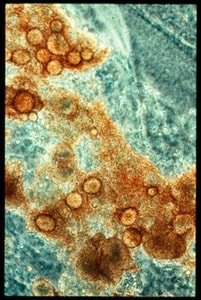
Bacterias reductoras del sulfato y azufre
Son δ-proteobacterias. Respecto a su metabolismo, podemos decir que son anaeróbicas estrictas, emplean como donador de electrones (fuente de poder reductor) compuestos orgánicos, pero es muy frecuente que sean productos de la fermentación de otros microorganismos como el lactato. Hay algunas que pueden usar hidrocarbonos e incluso el petróleo crudo como donador de electrones.
Impacto en el medio
Están presentes en ambientes acuáticos y terrestres que se han podido volver anóxicos como resultado de procesos microbianos de descomposición; por ejemplo, se encuentran en sedimentos anóxicos con abundante materia orgánica (fondos de pantanos, lagos, etc). El proceso produce sulfatos reducidos (sulfhídricos o sulfuros), y eso produce una capa de bacterias verdes y rojas de azufre que utilizaran el sulfhídrico producido por las sulfatorreductoras de los fondos de los pantanos. De esta manera se establece un ciclo anaeróbico del azufre.
Producen al año millones de toneladas de sulfhídrico. Tiene un olor desagradable a huevos podridos. Puede producir la precipitación de sulfuro de hierro dando un color negro. En zonas costeras, estas áreas se vuelven inhabitables tanto por el olor como por el efecto tóxico del sulfhídrico. En suelos encharcados puede ocasionar la muerte de animales, plantas y otros microorganismos. Es un peligro potencial porque se puede combinar con el hierro (Fe) de citocromos de cadenas de transporte electrónico de otros seres vivos, así como con otros compuestos celulares esenciales que contienen hierro.
Ejerce un impacto negativo a nivel de industria porque causa considerables pérdidas económicas al provocar o acelerar la corrosión anaeróbica de tuberías de hierro. Con las arqueas metanogénicas también tenemos este problema. También pueden encontrarse en el rumen de rumiantes y tracto intestinal de hombre y otros animales.
Clasificación
Hay dos tipos de bacterias que pueden reducir el sulfato, dependiendo de si oxidan el acetato o no:
- Tipo I: Desulfovibrio tiene forma de bacilo curvado con flagelación polar. Es de tipo I, no es capaz de oxidar el acetato y lo excretan.

- Tipo II: la mayoría son de origen marino. Son capaces de usar el acetato y otros ácidos orgánicos como única fuente de carbono, oxidándolos hasta CO2 y H2. Desulfobacter emplea el ciclo TCA modificado (CAC) para obtener ATP adicional. En estas bacterias es crucial el ciclo del H2 para la formación de un gradiente protónico para lo obtención de ATP. Presenta un flagelo polar único (aunque no todas las especies son móviles). Desulfuromonas no reduce sulfatos pero sí azufre. Posee forma de bacilo recto y flagelación subpolar.
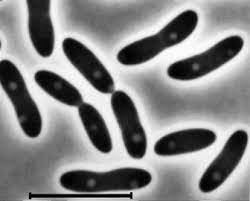
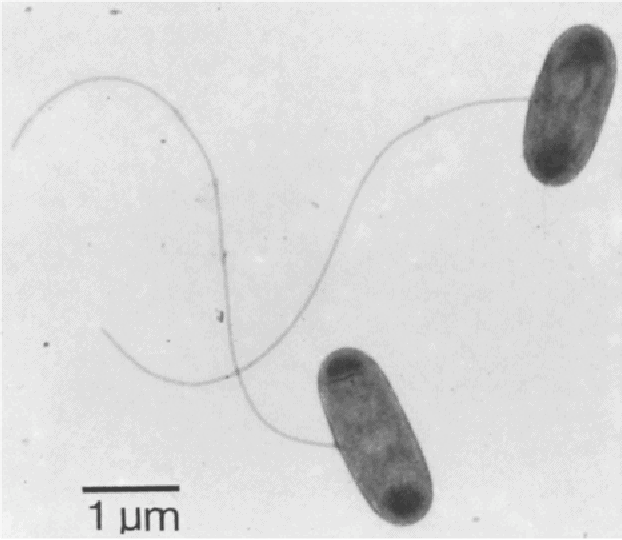
Proteobacterias del grupo epsilon
Campylobacter
Tiene forma de espirilo, microaerófilo con tendencia a ser anaerobio (viene a ppO2 muy baja). Móvil por flagelación monotrica polar. Podemos destacar dos especies:
- Campylobacter fetus. Provoca abortos en animales domésticos (ganado ovino, bovino,…)
- Campylobacter jejuni. Puede causar brotes de enteritis transmitidas por alimentos, en ocasiones se aísla con más frecuencia como causa de diarrea que Salmonella o Shigella.

Helicobacter
Es un espirilo microaerófilo que puede presentar de 1 a 6 flagelos en un polo. La especie más conocida es H. pylori, se asocia con casos de gastritis y úlceras pépticas en humanos. Incluso se ha considerado como causa de cáncer de estómago, ya que se ha visto que existe una correlación positiva entre los casos de cáncer gástrico e infección por H. pylori. Este descubrimiento supuso el premio nobel en 2005 a Barry Marshall y Robin Warren.

Está muy extendida entre toda la población mundial. En países en vías de desarrollo aproximadamente del 70-90% de población afectada, en desarrollados del orden de 25 a 50%. Se han hecho estudios que relacionan determinadas cepas con determinadas migraciones humanas a nivel mundial.
El modo exacto de transmisión no está del todo claro, aunque se especula que puede ir de individuo a individuo, fundamentalmente durante la infancia, aunque hay quien sostiene que es a través de agua y alimentos.
Coloniza estrictamente las células gástricas secretoras de mucus, por debajo de la capa del mucus gástrico. En este lugar produce inflamación que puede llevar consigo una úlcera. Se adhiere por medio de fimbrias. Entre los factores de virulencia podemos encontrar grandes cantidades de ureasa producidos por esta bacteria, la cual degrada la urea a CO2 + amoníaco. La hidrólisis de la urea está asociada con su virulencia. El amoníaco basifica el medio y podría proteger al microorganismo del pH ácido del estómago. Sin tratamiento antibiótico adecuado puede llegar a destruir el tejido y producir una úlcera.

Bibliografía de imágenes
Bouchal, T., Závada, J., Vojtková, H., Langarová, S., & Havelek, R. (2012). Primary Research of Mine Waters from the Chrustenice Iron-Ore Deposit/ Prvotní Průzkum Důlních Vod Železorudného Ložiska Chrustenice. GeoScience Engineering, 58, 23 - 27. DOI:10.2478/gse-2014-0041
Fung C, Tan S, Nakajima M, Skoog EC, Camarillo-Guerrero LF, Klein JA, et al. (2019) High-resolution mapping reveals that microniches in the gastric glands control Helicobacter pylori colonization of the stomach. PLoS Biol 17(5): e3000231. https://doi.org/10.1371/journal.pbio.3000231
Hylemon, Phillip. (1973). Designation of Spirillum volutans Ehrenberg 1832 as Type Species of the Genus Spirillum Ehrenberg 1832 and Designation of the Neotype Strain of S. volutans: Request for an Opinion. International Journal of Systematic and Evolutionary Microbiology. 23. https://doi.org/10.1099/00207713-23-1-20
Kuever, Jan; Rainey, Fred A.; Widdel, Friedrich. (2015). Desulfuromonas. Bergey's Manual of Systematics of Archaea and Bacteria. (John Wiley & Sons, Ltd): 1-7. https://doi.org/10.1002/9781118960608.gbm01011
Pfennig, N., & Biebl, H. (1976). Desulfuromonas acetoxidans gen. nov. and sp. nov., a new anaerobic, sulfur-reducing, acetate-oxidizing bacterium. Archives of microbiology, 110(1), 3–12. https://doi.org/10.1007/BF00416962
PLoS Biology Issue Image | Vol. 3(10) October 2005. PLoS Biol 3(10): ev03.i10. https://doi.org/10.1371/image.pbio.v03.i10
PLoS Biology Antisocial Behavior in Cooperative Bacteria (or, Why Can't Bacteria Just Get Along?). November 2005. PLoS Biol 3(11): e398. https://doi.org/10.1371/journal.pbio.0030398
Se consideran en conjunto a los géneros Rickettsia, Coxiella y Bartonella, ya que están encuadradas en el orden Rickettsiales y la familia Rickettsiaceae. Las rickettsias son un grupo heterogéneo de pequeños bacilos y cocobacilos GRAM negativos (-). Se desarrollan en el interior de la célula hospedadora, son parásitos intracelulares.
Índice de contenidos
Caracteres generales
Bartonella se encuentra evolutivamente cercana entre otros, de Rhizobium y Agrobacterium (relacionada con plantas), y esto ha dado a especular que las Rickettsias se originaron de bacterias que al principio eran infecciosas para plantas para ser después de animales.
Las Rickettsias tienen forma de coco o de bacilo o formas variadas (pleomórficas). Son todas proteobacterias GRAM negativas (-) e inmóviles. Coxiella y Rickettsia se consideran parásitos intracelulares estrictos; Bartonella se considera parásito intracelular pero facultativo. Crecen en eritrocitos, macrófagos y células del endotelio vascular de vertebrados, y a menudo también habitan en artrópodos que se alimentan de sangre: pulgas, garrapatas, piojos, entre otros; los cuales actúan como vectores u hospedadores primarios.
Tienen de particular el presentar una membrana permeable especial, por lo que son bastantes sensibles a la desecación. hace que su desecación sea bastante acusada y explica la necesidad de vectores de transmisión.
Hay una excepción en el caso de Coxiella, ya que podrá transmitirse a través del aire y a través de alimentos; no solo por vectores, gracias a que producen una forma de resistencia parecida a una endospora. Esto explica que además de poder sobrevivir en el aire, también resista la temperatura de pasteurización clásica (por eso hubo que elevar la temperatura) y el tratamiento con ciertos agentes antimicrobianos.
Parasitación
Entran en el hospedador mediante una fagocitosis inducida, que requiere que ambas partes (bacteria y hospedador) estén activos. Incluso ocurre en células que no son fagocíticas (células del endotelio vascular de vertebrados, por ejemplo). Cuando entran formarán un fagosoma (no rompen la membrana de la célula hospedadora).
En el caso de Rickettsia, entra por fagocitosis inducida formando un fagosoma; posteriormente degrada la membrana de ese fagosoma por medio de lipasas y es casi simultánea a la entrada por fagocitosis. Debido a esto, el fagosoma es casi indetectable, no constituye una fase intermedia. Fuera del fagosoma se dividen por fisión binaria, algunas especies se dividen en el núcleo y otras en el citoplasma. Finalmente, la célula hospedadora, dependiendo de la especie de Rickettsia, explota liberando la bacteria; en otros casos, se forman unas yemas que por contacto con la membrana permite finalmente la salida de las Rickettsias. Rompa o no la célula hospedadora, sufre daños debido al contacto tóxico de la pared celular de la Rickettsia con la pared de la célula hospedadora o por la rotura de la pared.
En el caso de Coxiella, entra por fagocitosis inducida, pero no se romperá la membrana del fagosoma, permaneciendo Coxiella en el fagosoma. Más tarde, se fusiona con el lisosoma, formando el fagolisosoma. Esta fusión es necesaria para activar el metabolismo de Coxiella, debido a que su metabolismo se acelera a pH 4,5 (pH del fagolisosoma), por lo que se multiplicará y saldrá lisando la célula.
Metabolismo
La Rickettsia respira glutamato o glutamina pero no degrada la glucosa. Esto parece proporcionarle sólo una pequeña cantidad de energía para el mantenimiento y no para el crecimiento; de ahí que sean parásitas intracelular. Tanto el glutamato como la glutamina la incorporan al ciclo TCA (en el intermediario α-cetoglutarato). Coxiella si respira glucosa, piruvato, etc. Bartonella respira ciertos ácidos orgánicos.
Tiene una cadena transportadora de electrones completa y obtienen el ATP por fosforilación oxidativa. Su capacidad biosintética es limitada, así que el resto de nutrientes los obtiene a partir de la célula hospedadora; para ello posee un sistema de intercambio de ADP endógeno por ATP exógeno (afecta a la célula hospedadora). Así, gran parte de la energía necesaria para el crecimiento se satisface por el metabolismo del propio hospedador.
El hecho de ser parásitas intracelulares las hace peculiares en cuanto al tratamiento con agentes quimioterápicos y antibióticos. Son resistentes a muchos antibióticos por desarrollarse en el interior del hospedador, pero pueden ser tratados con ciertos antibióticos como tetraciclinas o cloranfenicol. También son sensibles a las sulfamidas (Ejemplo: TMP-SMZ).
Suelen ser identificadas por pruebas serológicas.
En la siguiente tabla podemos ver las diferencias entre los 3 géneros de forma resumida.
| Bacteria | Rickettsia | Coxiella | Bartonella |
|---|---|---|---|
| Lugar de multiplicación | Citoplasma | Fagolisosoma | Superficie exterior de la célula |
| Parásito intracelular estricto | + | + | - |
| Puede cultivarse de forma axénica | - | - | + |
| Formación de esporas | - | + | - |
| Enfermedades humanas | Tifus, fiebre manchada de las Montañas Rocosas, etc | Fiebre Q | Fiebre de las trincheras |
Ahora lo veremos todo de forma más específica.
Rickettsia
Produce distintos tipos de tifus.
R. rickettssii
Produce la denominada "fiebre manchada de las Montañas Rocosas" que afecta a una zona de Norteamérica donde se encuentra el tipo de garrapata que es el vector de transmisión. Recibió el nombre en honor a Howard Taylor Ricketts (1871-1910), quien murió de tifus.
Ésta puede crecer tanto en el citoplasma como en el núcleo y usa una garrapata como vector. Puede que se transmita de generación en generación a través de los huevos por una transmisión transovárica o por garrapata-perro-humano.
Esta fiebre se caracteriza por cefaleas, escalofríos, aumento de la fiebre y un exantema (ronchas) cutáneo rojizo que comienza en muñecas y tobillos y después se extiende al tronco. Si no se trata puede afectar al corazón, pulmones y provocar incluso la muerte. Tiene tratamiento con antibióticos.
R. prowazeckii
Provoca el tifus exantemático o tifus epidémicos. Tiene una distribución mundial porque el vector que emplea es el piojo humano. Recibe el nombre de prowazekii en honor al Stanislav von Prowazek, que murió de tifus. Hoy en día hay tratamientos con antibióticos, además de una vacuna que se aplica a individuos de alto riesgo.
R. typhi (R. mooseri)
Provoca el "tifus endémico o murino". El nombre se le dio en honor a Herman Mooser que diferenció R. typhi de R. prowazekii. Se llama murino porque lo transmiten las pulgas de las ratas, las cuales pueden picar a las ratas o al hombre. Es una infección que puede permanecer indefinidamente en las ratas. La tasa de muerte es menor (<5%).
R. tsutsugamushi
Causa la fiebre fluvial japonesa o "scrub", y tiene una distribución oriental (Asia y Oceanía). El vector de transmisión es una garrapata que afecta a ratones de campo, que actúan de reservorio.
Coxiella
Coxiella burnetii
Causa la llamada "fiebre Q". El primero en investigarla fue Frank Mcfarlene Burnet y recibió el premio nobel en 1960. Se transmite por picadura a los animales de varias especies de garrapatas y estos animales infectados pueden parecer asintomáticos.

En el caso del hombre se suele transmitir por el aire, por inhalación de polvo contaminado por restos que contienen a estas bacterias, las cuales suelen estar en las heces, orina y leche de animales que están contaminados.
Después de inhalar ese polvo pasa a los pulmones donde prolifera y puede provocar inicialmente unos problemas respiratorios similares a la gripe y fiebre intensa. También puede provocar una endocarditis quellega a aparecer a los años desde la infección inicial. Durante todo ese tiempo lo normal es que permanezca en el hígado produciendo hepatitis.
La fiebre Q aparece normalmente en gente que trabaja en mataderos, granjas, etc. Se previene normalmente con vacunas en personas de alto riesgo, en zonas endémicas y pausterizando la leche.
Bartonella
Son bacilos curvados, pequeños y flagelados. Parasita células endoteliales y eritrocitos. A diferencia de las otras en las que hacía falta que el parásito y el hospedador tenían que estar activos, en Bartonella el hospedador (eritrocito) es pasivo, no contribuye a la entrada de las bacterias. Al entrar dañan su membrana, entra por endocitosis, pero no incita la fagocitosis como Coxiella y Rickettsia.
Es cultivada en condiciones axénicas en medio de una moderada complejidad. Entran gracias a los flagelos que poseen.
Bartonella quintana
Produce la "fiebre de las trincheras", (fiebre de los 5 días) que tuvo un gran impacto en la primera guerra mundial. Es una de las especies que no se desarrolla en el interior sino en la superficie externa, es decir, tienen una localización epicelular. Tiene una distribución mundial ya que el conductor es el piojo humano y el reservorio el hombre.
B. henselae
Produce la "enfermedad por arañazo de gato" (EAG). El vector es la pulga del gato y el gato es el reservorio. Estas sí viven dentro del eritrocito y el animal no muestra síntomas de la enfermedad. Causa fiebre e inflamación de los ganglios, que desaparece a lo largo de meses.
Otras proteobacterias
Agrobacterium
Son alfa-proteobacterias y están relacionadas con Rhizobium y Bartonella. Son bacilos con flagelación peritrica y además son fitopatógenos de dicotiledóneas como manzana, tomate, patata, etc. Algunas especies más destacadas son:
- A. rhizogenes. Causa raíces pilosas codificadas por un plásmido Ti.
- A. tumefaciens. Causa tumores en forma de agallas de corona localizadas en la zona de unión entre el tallo y la raíz, es decir, en el cuello. Esta transformación se produce cuando la bacteria transfiere un fragmento del plásmido Ti (tumor inducido) al material genético de la planta. Una vez inducida la agalla (tumor) puede seguir creciendo en ausencia de la propia bacteria. La formación del tumor se clasifica en 5 etapas.
Formación del tumor
Infección, reconocimiento y adherencia
Las células de A. tumefaciens se adhieren a las heridas de la planta, ya que estas heridas producen la liberación de compuestos fenólicos que las bacterias reconocen y que a la vez permiten la adherencia de ésta a la planta, activándose el proceso de transformación y formación de estos tumores. El reconocimiento bacteria-planta se produce por receptores.
El receptor vegetal es un tipo de pectina que es un polisacárido complejo que contiene y el receptor bacteriano tiene beta-glucanos que están incrustados o formando parte del lipopolisacárido de la pared celular de la bacteria. Tras ese reconocimiento, la bacteria sintetiza microfibrillas de celulosa para ayudarse a anclarse a la planta, formando unos grandes agregados bacterianos en la pared celular que facilitan la colonización.
Procesado del fragmento T-DNA del plásmido Ti
El plásmido Ti es bastante grande (unas 200 kb) pero contiene una región más pequeña denominada región T-DNA (unas 20kb) que es la que se transfiere al cromosoma vegetal. Dentro de la región T-DNA encontramos distintos genes que intervienen en la formación del tumor:
- Genes Onc (oncogenes): codifican enzimas que intervienen en la producción de fitohormonas, que estimulan la división celular y forman el tumor.
- Genes Ops (opinas): son genes que llevan la información genética para sintetizar opinas, que son aminoácidos modificados poco corrientes que emplea la bacteria como fuente de carbono y nitrógeno.
Dentro del plásmido Ti encontramos también distintos genes:
- Genes Vir (virulencia) que codifican proteínas esenciales para transmitir el fragmento T-DNA:
- Genes de transferencia (que codifican el puente conjugativo).
- Genes responsables de la degradación de opinas, para su posterior uso por la bacteria.
- Genes del sistema de doble componente.
La expresión de estos genes se induce por moléculas señal sintetizadas por los tejidos vegetales heridos como lo son ciertos compuestos fenólicos.
Transferencia del fragmento T-DNA por conjugación
Los compuestos fenólicos (sintetizados por los tejidos heridos de la planta) serán detectados por la bacteria, produciéndose un incremento de síntesis del gen VirA, el cual se adhiere a la membrana de la bacteria y actúa de sensor. A continuación VirA, como es una proteín-quinasa, activa por fosforilación al producto de VirG, que actúa de efector induciendo la transcripción de otros genes Vir al fosforilarse.
VirA y VirG constituten un sistema de dos componentes: se encuentran en procariotas superiores y en eucariotas y se emplean para la transmisión de señales al exterior. VirD codifica a una endonucleasa que va a cortar en una zona justo al lado de lo que se va a transferir (T-DNA). A continuación, actúa el producto de VirE, que es una proteína de unión que se une al lado de la cadena del DNA. Una vez cortado el T-DNA se une al fragmento y lo transporta a la célula vegetal. Finalmente, VirB forma el puente entre la bacteria y la célula vegetal para que se integre el T-DNA.
Integración del T-DNA en el genoma de la planta
Se integra en sitios con repeticiones en tándem específicas, inversas o directas.
Génesis de tumores y producción de opinas
El T-DNA codifica hormonas (opinas) para la planta que inducen la división de las células de la misma, produciendo un tumor. Presentan unos enzimas que permiten la catálisis de las opinas para su uso.
Tanto la bacteria como todos los procesos que lleva a cabo, han sido muy estudiados por su capacidad como vector en biotecnología de plantas. Así se han creado plantas transgénicas resistentes a determinados herbicidas o al ataque de determinados adversarios.
Brucella
Es una alfa-proteobacteria en forma de coco o bacilo e inmóvil. Es de interés clínico y es capaz de vivir frente a la fagocitosis. Pueden sobrevivir latentes meses o incluso años dentro de los fagocitos sin verse afectados por las defensas del organismo.
Es parásita intracelular facultativa. Causa la brucelosis en mamíferos, también llamada fiebre de malta o fiebres ondulantes.
Bordetella
Es una beta-proteobacteria en forma de bacilo pequeño e inmóvil. Las cepas virulentas tienen capsula, cuya formación está asociado con la toxicidad/ patogenicidad.
La más conocida es B. pertussis que causa la tos ferina. Esta especie solo afecta al hombre, y no soporta la fagocitosis. La tos ferina causa unos accesos paroxisticos de tos acompañados de una inspiración jadeante, similar a una especie de grito.
Francisella
Francisella que es una gamma-proteobacteria que cambian de forma dependiendo de la fase de crecimiento (bacilares en fases exponenciales y filamentosas en fase estacionaria), es decir, es pleomórfica. Son pequeños. Tiene una tinción de Gram bastante débil, aunque es GRAM(-).
Las cepas virulentas presentan capsula, y pueden sobrevivir a la fagocitosis. Es exigente y requiere medios complejos enriquecidos.
La más conocida es la F. tularensis (nombre que proviene del condado de Tulare, en California, donde se produjo la primera epidemia) que causa la tularemia. En realidad es una zoonosis propia de lagomorfos y roedores, pero que puede afectar al hombre y otros animales. Además presenta diferente sintomatología dependiendo de la vía de infección. Se puede adquirir por inhalación, ingestión, picadura de vectores artrópodos o a través de heridas, pero no de humano-humano. Provoca la inflamación de los ganglios linfáticos. Puede causar pneumonía, septicemia, abcesos (inflamación), etc. Es una bacteria que resiste meses a muy bajas temperaturas, bajo suelo, en plantas, agua, etc. Se le considera una posible arma biológica junto con Bacillus anthracis y Yersinia pestis (clasificados en el Grupo A por su virulencia, su resistencia y su gran infectividad).
Neisseria
Es otra beta-proteobacteria con forma de diplococo inmóvil. Algunos son capsulados (cápsula polisacárida en cepas virulentas). A veces presentan fimbrias que las usan para colonizar las mucosas.
Son aerobias estrictas y crecen a temperatura corporal. Algunas son inocuas (no causan problemas en el hombre) incluso algunas forman parte de la microbiota del hombre, pero otras son patógenas como N. gonorrhoeae (gonococo) que causa la gonorrea o N. meningitidis (meningococo) que causa la meningitis meningocócica.
Legionella
Es una gamma-proteobacteria. Tiene forma de bacilo con tendencia a ser filamentosos, móviles gracias a la presencia de flagelos polares o subpolares. También GRAM negativos (-) pero débiles porque se tiñen mal.
También sobrevive a la fagocitosis, de hecho inhibe la etapa de fusión del fagosoma con el lisosoma (para formar el fagolisosoma). Controla el transporte del fagosoma dentro del fagocito al retículo endoplasmático (RE) (orgánulo rico en nutrientes); dentro del retículo endoplasmático se multiplica y pasa desapercibido durante mucho tiempo dentro de este RE, asegurándose su supervivencia. Todas las especies de Legionella están implicadas como causa de neumonía en el hombre.

La especie tipo es L. pneumophila, que causa una neumonía denominada legionelosis. Es denominada así porque en 1976 muchos miembros de la legión americana murieron por una infección por esta bacteria. Tardaron en averiguar la causa de aquel brote de neumonía porque intentaban cultivar el agente en medios convencionales, pero necesita un medio rico (es nutricionalmente exigente).
Finalmente, lo identificaron al darse cuenta de que no crece en medios de cultivo habituales y que tiene mala tinción. Se aislaron a partir de cobayas infectadas con tejido procedente de pacientes infectados. Ya existen medios especiales de crecimiento para este microorganismo. Crecen en medios complejos enriquecidos, aunque tarda mucho en crecer.
Tiene tratamiento antibiótico y es un microorganismo que de forma natural se encuentra en aguas, pero no de forma libre sino que se encuentra en el interior de amebas que se pueden considerar como fagocitos naturales. Tiene facilidad para colonizar tuberías de suministro de agua caliente, sistemas de refrigeración de aires acondicionados.
En 2001 en Murcia hubo una epidemia, aunque hubo pocos fallecidos.
Dentro de las proteobacterias quimioorganótrofas anaerobias facultativas vamos a tratar tres familias: Enterobacteriaceae, Vibrionaceae y Pasteurellaceae. De ellas, la más conocido es la familia de las enterobacterias. Todas ellas tienen en común la prueba de la catalasa: son catalasa+.
Índice de contenidos
Familia Enterobacteriaceae
Las enterobacterias son un grupo relativamente homogéneo desde el punto de vista filogenético, encuadrado dentro de las γ-proteobacterias (gamma). Son las bacterias más estudiadas en los laboratorios.
Caracteres generales
Respecto a su morfología, podemos decir que son bacilos rectos, no formadores de endosporas que, o carecen de movilidad, o presentan movimiento mediante flagelación perítrica. Pueden tener fimbrias de tipo I (permiten adherirse a superficies mucosas, es común adherirse a la superficie de la mucosa del tracto intestinal) y tipo II (son pilis sexuales, les permiten transferir información genética entre células, que a menudo incluye genes de resistencia a antibióticos). Esta información que se transfiere está contenida en plásmidos susceptibles de transferencia horizontal. Aproximadamente el 17% de los genes de E. coli han sido adquiridos por transferencia horizontal.
Podemos encontrarlas en el tracto intestinal de forma inocua; otras tienen aplicación industrial, pero también se incluyen algunas patógenas para el hombre, animales y plantas. Con frecuencia se aíslan de individuos enfermos, por lo que se han ideado una gran serie de pruebas para su rápida identificación y tratamiento. Las características fenotípicas han sido tradicionalmente muy empleadas para distinguir géneros de enterobacterias.
Pueden producir bacteriocinas, que se supone que podrían ayudar a mantener un equilibrio entre las distintas enterobacterias del intestino.
Nutrición. Indentificación de enterobacterias
No tienen requerimientos nutricionales especiales. Fermentan azúcares (en condiciones anóxicas) hasta sus productos finales. El tipo y proporción de productos de fermentación obtenidos a partir de glucosa permite clasificarlas en dos tipos: las de fermentación acido-mixta y butanodiólica. Normalmente reducen nitratos a nitritos (cuando no haya oxígeno, pueden usar el nitrato como aceptor final de electrones).
El uso o no de determinados disacáridos tiene carácter sistemático, como la capacidad de fermentar la lactosa, que depende de que la bacteria posea β-galactosidasa, una permeasa y una epimerasa (Escherichia y Enterobacter son lactosa+; Proteus, Salmonella o Shigella son lactosa-). Las podemos distinguir cultivándolas en un medio con lactosa.
Existen muchas técnicas y pruebas bioquímicas para el aislamiento e identificación de enterobacterias, para las cuales se emplean toda una serie de medios selectivos o diferenciales (medio Kligler, McConkey, pruebas IMViC, API), colimetrías que permiten determinar la calidad microbiológica del agua y también la prueba de la catalasa (da positivo, catalasa+) y la de oxidasa (da negativo, oxidasa-, no poseen citocromo C en la CTE). Éstas últimas tienen carácter sistemático, permite diferenciarlas de otras familias.
También hay pruebas serológicas; se pueden distinguir atendiendo a los antígenos presentes en su superficie (para diferenciar especies o cepas).
Fermentadores ácido mixtos
Escherichia
Es la bacteria más estudiada y el microorganismo de experimentación elegido por muchos microbiólogos. Son cocobacilos (o bacilos cortos) móviles con flagelación perítrica o inmóviles. Presentan fermentación acido-mixta y producen gas por la oxidación del fórmico. Es indol+.

La especie más conocida es E. coli, produce un tipo de bacteriocinas denominadas colicinas. Reside en el colon de humanos y otros animales homeotermos, donde sintetizan vitamina K. Al ser anaerobios facultativos, ayuda a consumir el oxígeno volviendo anaerobio el intestino grueso. En su mayoría, las cepas son inocuas, aunque algunas pueden causar infecciones gastrointestinales o del tracto urinario. E. coli es un indicador de contaminación de origen fecal en aguas o alimentos; es decir, si hay presencia de esta bacteria hay contaminación de origen fecal.
Proteus
Son bacilos muy móviles con flagelación perítrica. Presentan fermentación ácido-mixta y producen gas. Poseen la enzima ureasa que les permite degradar la urea, por lo que son ureasa+.
Gracias a la rápida movilidad del microorganismo, cuando las colonias crecen en placa a menudo muestran un patrón característico de crecimiento zonal (crecimiento en círculos concéntricos en algunos). Esto de sebe a que las más alejadas de la colonia tienen más movilidad, se separan y alejan. Llega un momento en el que experimentan una reducción de movilidad, entonces se paran. Cuando detienen su movimiento, se dividen y forman una nueva colonia en la que ocurrirá lo mismo.

Habita en el suelo, es muy abundante en restos de animales en descomposición. Es habitual en el intestino de animales homeotermos (incluido el hombre) y está presente en aguas polucionadas. Se le puede considerar como patógeno oportunista, implicado en ciertas infecciones del tracto urinario, diarreas infantiles o como invasor secundario en la infección de heridas. Las dos especies más conocidas son P. vulgaris y P. mirabilis.
Salmonella
Es un bacilo móvil por flagelación perítrica, a menudo con cápsula. Presentan fermentación acido-mixta y normalmente producen gas (aunque depende de la especie). Es citrato+. Es común en el tracto intestinal de muchos animales homeotermos como ganado vacuno y aves de corral y en animales poiquilotermos (lagartos, tortugas...). Bajo condiciones de baja salubridad puede contaminar alimentos. Casi todas las especies se pueden considerar patógenas potenciales.
La más conocida es Salmonella typhi, causa las fiebres tifoideas, una enfermedad grave que se adquiere por la ingesta de aguas contaminadas por heces de personas o animales afectados. Otras especies producen tipos de gastroenteritis denominadas salmonelosis, menos graves que las anteriores, siendo la causa más común del envenenamiento de comida por salmonelosis la especie Salmonella typhimurium.
Se clasifican en base a 3 antígenos de superficie; se han podido establecer más de 2000 serotipos que a su vez se subdividen en biotipos. Al inyectar Salmonella en un animal se induce la formación de anticuerpos frente a determinadas estructuras de la bacteria. La reacción antígeno-anticuerpo permite diferenciar cepas dentro de una misma especie indistinguibles por otras características fenotípicas. Son el denominado antígeno O (lipopolisacárido de la membrana externa de la pared celular) o antígeno somático, antígeno H o antígeno flagelar (flagelina), antígeno K o Vi (antígeno capsular). El diagnóstico de laboratorio se establece por la presencia de esta bacteria en orina, heces, sangre, etc. Existe también una vacuna.
Shigella
Son bacilos inmóviles, no produce gas en la fermentación. La especie más conocida es Shigella dysenteriae, causante de la disentería bacilar o shigelosis, una enfermedad gastrointestinal. Contamina alimentos y produce una neurotoxina que causa enterotoxicidad que afecta al tracto digestivo. Se transmite por el agua o alimentos.
Yersinia
Son cocobacilos bastante pequeños, no producen gas. Muchas especies no son móviles a temperatura corporal, pero si es inferior a 30ºC sintetizan los flagelos perítricos y se vuelven móviles.
Una excepción a esto es Yersinia pestis, la especie más conocida, que es siempre inmóvil. Esta especie causa la peste bubónica o peste negra, se transmite a través de las pulgas de las ratas.

Fermentación butanodiólica
Están más relacionados entre sí que los anteriores:
Enterobacter
Son bacilos bastante cortos o cocobacilos, móviles con flagelación perítrica. Producen gas en la fermentación (complejo hidrogenoliasa fórmica). La mayoría de especies tienen la capacidad de licuar la gelatina.
Es ubicuo, lo podemos hallar en suelos, aguas y animales formando parte de la microbiota normal. Hay dos especies conocidas que se pueden considerar patógenas oportunistas, ocasionando infecciones del tracto urinario y son comunes en infecciones nosocomiales, como E. aerogenes. Se le puede considerar como el prototipo de este género, común en suelos aguas y tracto intestinal. La otra especie es E. cloacae.
Klebsiella
Son bacilos inmóviles y capsulados. Pueden presentarse aislados, en parejas o incluso en cadenas cortas. Todos los que presentan cápsula, cuando se cultivan en placa tienen un aspecto mucoide o viscoso. Producen gas como los anteriores. La mayoría de cepas tiene la capacidad de fijar nitrógeno en condiciones anaerobias.
La especie más conocida es K. pneumoniae, la principal causa de septicemia en salas de pediatría, y también causa neumonía, que puede afectar a personas con infecciones previas del tracto respiratorio superior e incluso en individuos con alcoholismo crónico.
Klebsiella tiene una particularidad: sus resultados en laboratorio respecto a sensibilidad a ciertos antibióticos difieren con los que ocurren in vivo. Así, Klebsiella es sensible a ampicilina in vitro pero resistente in vivo, de forma que la ampicilina no sería un antibiótico recomendable para el tratamiento de Klebsiella.
Serratia
Son bacilos móviles con flagelación perítrica, no producen gas. Pueden estar de forma natural en suelos, agua, tracto intestinal de insectos y vertebrados, pero sólo ocasionalmente en el intestino humano.
La especie más conocida es S. marcescens, patógeno oportunista. Aislada en catéteres, soluciones salinas y otras soluciones supuestamente estériles. Puede producir infecciones del tracto urinario y respiratorio.
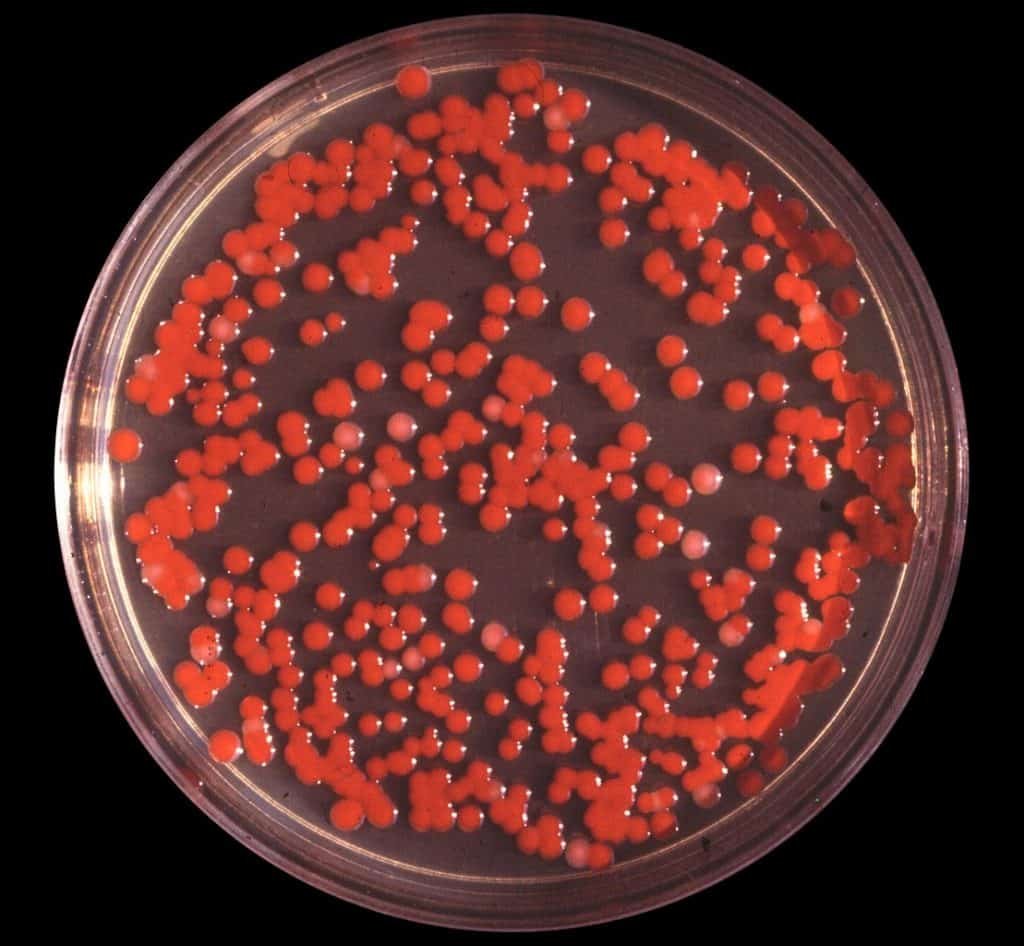
Forma colonias coloreadas de color rosado, anaranjado, violeta. Muchas cepas producen un pigmento denominado prodigiosina (derivado tripirrólico lineal que produce Serratia en fase estacionaria como un metabolito secundario). A él se deben ciertos sucesos considerados milagros en la edad media. La prodigiosina tiene interés porque ese anillo pirrólico es característico en pigmentos relacionados con transferencia de energía, pero no existen pruebas de que intervenga en la transferencia de energía y no se sabe su función. Pueden producir infección urinaria y del tracto respiratorio.
Erwinia
Son bacilos bastante largos, móviles con flagelación perítrica. Tampoco producen gas. Está relacionada con plantas, algunas son fitopatógenas y responsables de la putrefacción de ciertas plantas. Algunas son saprófitas o se consideran constituyentes de la microbiota epífita.

Erwinia amylovora causa enfermedades necróticas en el peral y plantas relacionadas.
En el caso de Erwinia carotovora, esta destruye los tejidos de reserva de algunas plantas debido a la presencia de enzimas pectinolíticos que destruyen todos los componentes pépticos, que en tejido vegetales sirven como cementantes.
Mientras, Erwinia herbicola produce unos pigmentos amarillos que aparecen en la superficie de algunas hojas de plantas aparentemente sanas.
Familia Vibrionaceae
Incluye bacilos rectos o curvados que presentan movimiento por flagelación polar.
En cuanto a su metabolismo, son fermentadores en condiciones anaeróbicas, cuando no hay oxígeno fermentan. El tipo de fermentación, a diferencia de las enterobacterias, va a depender de la especie y en ocasiones de la cepa.
La mayoría son acuáticas, presentes tanto en agua dulce como marina. Son oxidasa(+), a diferencia de las enterobacterias. Son también catalasa(+).
Vibrio
El género Vibrio es el principal. Algunos vibrios se han escindido en el género Aliivibrio. Tienen forma de bacilo curvado, móviles por un flagelo polar envainado. La mayoría tienen fermentación acido-mixta, y algunos con la capacidad de ser bioluminiscentes.
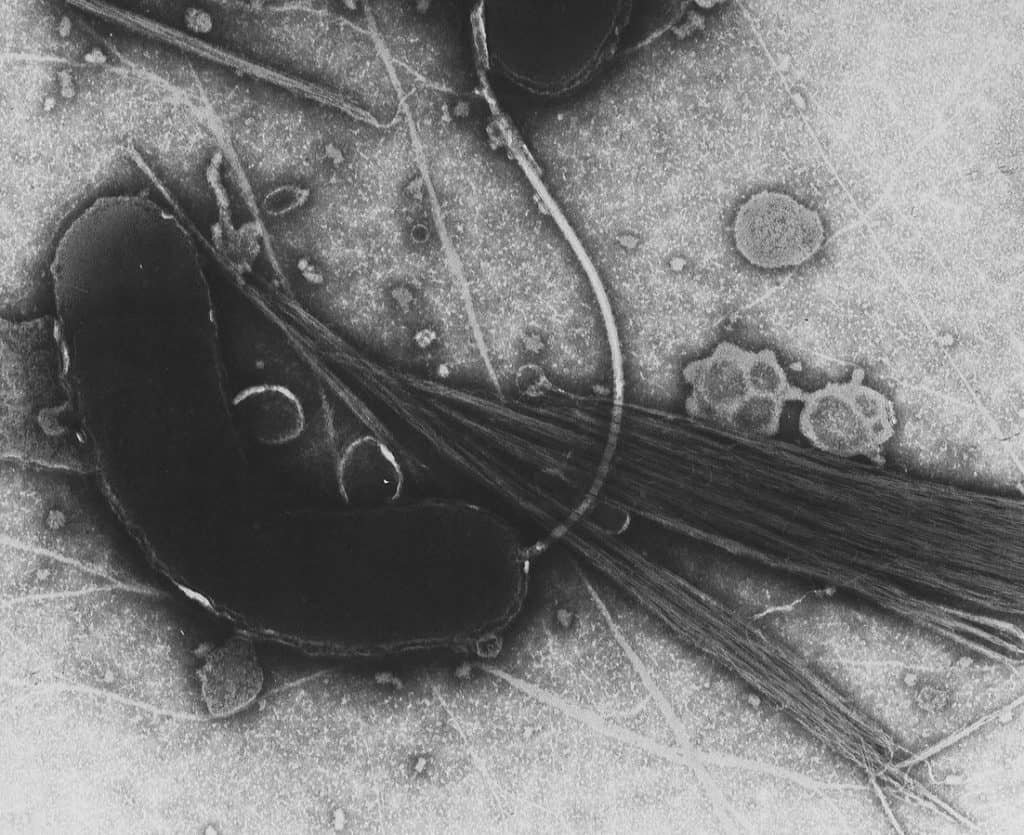
Muchas especies son inocuas, pero algunas son patógenas como Vibrio cholerae, causante del cólera en humanos. Es una de las enfermedades infecciosas más comunes en los países subdesarrollados; se transmite casi exclusivamente por el agua, y produce una neuroaminidasa que rompe el epitelio cementante del tracto intestinal. Produce también una exotoxina: exotoxina colérica o colerágeno (es una enterotoxina).
Es uno de los pocos GRAM negativos (-) que produce exotoxinas, ya que la mayoría son producidas por GRAM positivos (+). El paciente pierde masivamente líquidos y electrolitos debido a una alteración en la permeabilidad para los iones de la pared intestinal, lo que se asocia a espasmos importantes de los músculos abdominales, fiebre, vómitos y diarrea acuosa. Puede llevar a producir la muerte por la elevada concentración de proteínas en la sangre (shock y colapso respiratorio y circulatorio).
Vibrio parahaemolyticus es habitante habitual de aguas marinas costeras, puede ser transmitido al hombre por la ingestión de marisco crudo o poco cocido; causa gastroenteritis aguda.
Photobacterium
También se trata de bacilos móviles por la presencia de un penacho de 1 o 3 flagelos sin vaina. Según la cepa presentan un tipo de fermentación ácido-mixta o butanodiólica.
Es una bacteria marina y hay varias especies bioluminiscentes como P. phosphoreum y P. leiognathi.
Familia Pasteurellaceae
Son pequeñas e inmóviles. Todas son GRAM negativas (-), y suelen ser oxidasa (+). Su fermentación es ácido mixta, pero sin producción de gas (gas(-)). Además, son patógenos de vertebrados. Los géneros más representativos son:
Pasteurella
Son patógenos de animales domésticos y muchas cepas son pleomórficas, es decir, presentan mucha diversidad de formas. Pasteurella puede producir septicemia en el ganado vacuno, cólera aviar en animales de corral y también neumonía en otros animales.
La más conocida es P. multocida que es transmitida al hombre por las mordeduras de perros o de gatos, algunas cepas son patógenas y causa el cólera aviar.
Haemophilus
Presenta pleomorfismo bastante marcado. Es parásito obligado de diversas mucosas, como del tracto respiratorio, genital e intestinal.

La más destacada es H. influenzae que se creyó en principio que era la responsable de la gripe (de ahí lo de influenzae). Puede producir meningitis, otitis media, artritis séptica y diferentes afecciones dependiendo del órgano al que actúa (si afecta a los bronquios bronquitis, a los pulmones neumonitis, etc). También puede ocasionar sépsis puerperal en las mujeres tras un parto o un aborto, o al recién nacido.
Además, su nombre, haemo-, deriva de su requerimiento de sangre en su medio de cultivo, ya que gran parte de sus citocromos de la cadena de transporte de electrones (CTE) los adquiere de los grupos hemo de la sangre.
Bibliografía de imágenes
Centers for Disease Control and Prevention. (2019) Shigella – Shigellosis: Preguntas y respuestas. Revisado por última vez el 11 de mayo de 2021 en: https://www.cdc.gov/shigella/esp/general-information.html
Hamilton, A. L., Kamm, M. A., Ng, S. C., & Morrison, M. (2018). Proteus spp. as Putative Gastrointestinal Pathogens. Clinical microbiology reviews, 31(3), e00085-17. https://doi.org/10.1128/CMR.00085-17
Stewart EJ, Madden R, Paul G, Taddei F (2005) Aging and Death in an Organism That Reproduces by Morphologically Symmetric Division. PLOS Biology 3(2): e45. https://doi.org/10.1371/journal.pbio.0030045
Surico, Giuseppe & Mugnai, Laura & Pastorelli, Roberta & Giovannetti, Luciana & Stead, David. (1996). Erwinia alni, a New Species Causing Bark Cankers of Alder (Alnus Miller) Species. International Journal of Systematic Bacteriology. 46. 720-726. https://doi.org/10.1099/00207713-46-3-720
Todas las proteobacterias quimioorganótrofas aerobias son GRAM negativas (-). Vamos a hablar de 3 grupos: Las Pseudomonadáceas, las bacterias del ácido acético y las fijadoras de nitrógeno.
Índice de contenidos
Pseudomonadáceas
El género conocido como Pseudomonas constituye un grupo heterogéneo que pertenece a 3 clases de protebacterias (α, β y γ). Se clasifican en 7 grupos atendiendo a homologías del rRNA, que se han subdividido según rasgos fenotípicos: presencia de PHβ, producción de un pigmento fluorescente, patogenicidad, presencia de arginina-dihidrolasa, empleo de glucosa, etc.
Son bacilos rectos o ligeramente curvados, móviles, con flagelación polar, y quimioheterótrofas. Son fáciles de cultivar porque no tienen requerimientos nutritivos complejos. Algunas se pueden considerar quimiolitoautótrofas como Pseudomonas pseudovorans, capaz de oxidar el hidrógeno. Son catalasa + y oxidasa +.
Llevan a cabo respiración aeróbica por la vía de Entner-Doudoroff (ED), con el ciclo de Krebs completo. Presentan oxidación completa de la glucosa, pudiendo usar como aceptor final de electrones oxígeno o nitratos (como Pseudomonas denitrificans).
Hay una serie de pruebas identificativas que ayudan a distinguir pseudomonadáceas de enterobacterias. Por ejemplo, la ausencia de producción de gas en el consumo de glucosa: se coloca un tubo pequeño con caldo de cultivo y se le introduce una campana de Durham (que es un tubo pequeño también) y ver si se forma una burbujita, lo que sería indicativo de la producción de gas. En pseudomonadáceas no se produce gas. La prueba O/F (oxidación+/fermentación-) permite distinguir los microorganismos que llevan a cabo la respiración oxidativa de la fermentación.
Muchas producen una serie de pigmentos hidrosolubles que excretan al medio. Pseudomonas aeruginosa produce un pigmento azul denominado piocianina, u otro verde en algunas cepas: pioverdina. Hay pseudomonas (como Pseudomonas fluorescens) que son fluorescentes a luz ultravioleta.
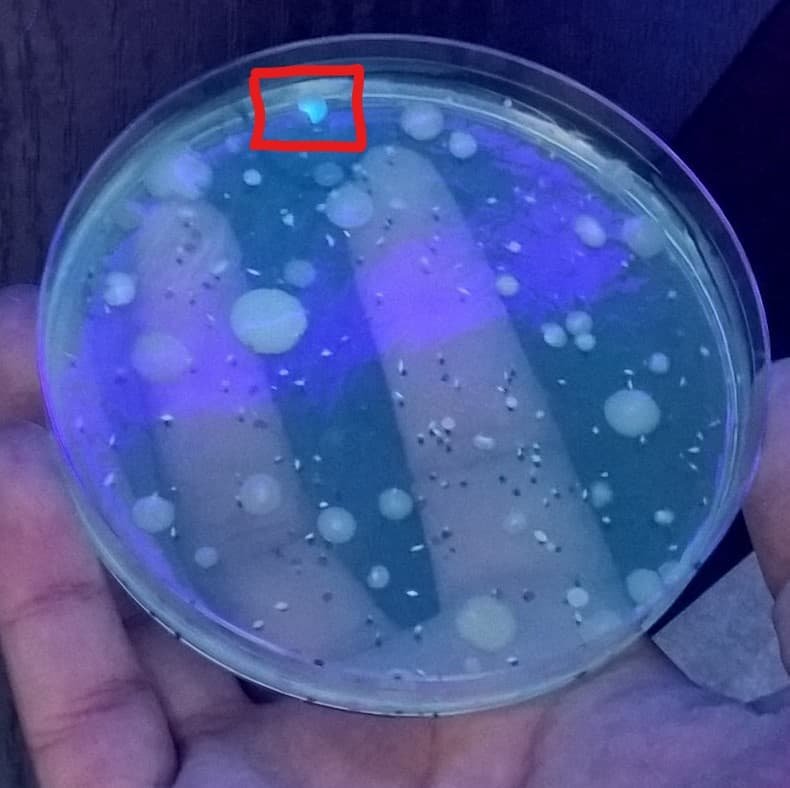
Podemos hallar pseudomonadáceas en aguas, suelos, y muchos otros hábitats. Hay inocuas y algunas son patógenas de animales como P. aeruginosa o de plantas, como Xanthomonas campestris. Muchas especies son mesófilas, pero algunas son psicrófilas. Son las responsables de proporcionar sabores, olores, colores, a ciertos alimentos refrigerados en mal estado (producen cambios en las propiedades organolépticas de los alimentos)
Pueden usar como fuente de carbono y energía compuestos pocos corrientes, incluso algunos de origen sintético: xenobióticos, como pesticidas y otros productos químicos tóxicos, gracias a la producción de una serie de enzimas capaces de degradar estos compuestos. Estos enzimas están codificados por plásmidos. Desde el punto de vista medioambiental les permite ser considerados como agentes de biorremediación (uso de organismos para tratar de eliminar/solucionar problemas medioambientales, como contaminación).
Aunque algunas especies pueden causar auténticos problemas en lugares como hospitales o laboratorios de síntesis de medicamentos y otras sustancias, ya que son capaces de crecer sobre adhesivos, jabones o antisépticos (compuestos de carbono cuaternario).
Suelen producir bacteriocinas (proteínas de elevado peso molecular que afectan a especies cercanas a las especies que las producen). En el caso concreto de pseudomonadáceas se denominan biocinas.
Pseudomonas aeruginosa
Es la especie más significativa. Es un patógeno oportunista, especialmente en hospitales. Las infecciones adquiridas en hospitales se denominan infecciones nosocomiales. No causa problemas en individuos sanos, pero si el individuo está inmunocomprometido (defensas bajas), puede llegar a infectar heridas, quemaduras, tracto urinario; y causar meningitis, abscesos e incluso septicemia (enfermedad asociada con la presencia en sangre de agentes patógenos o toxinas bacterianas producidas por esos patógenos).
Es resistente a la mayoría de los antibióticos de uso común, aunque hay algunos a los que es sensible: esta resistencia está relacionada por una parte con el pequeño tamaño de las porinas y a la presencia de genes que confieren resistencia, localizados en los plásmidos R.
Zooglea
Posee la típica morfología de bacilo con flagelación polar como Pseudomonas aeruginosa. Es importante para el tratamiento aerobio de aguas residuales, ya que oxida con mucha eficacia grandes cantidades de materia orgánica del efluente hasta CO2 y agua.
Xanthomonas
Es fitopatógeno. Causa varias lesiones necróticas en plantas. Se caracteriza por el tipo de pigmentos que produce: amarillos, muy llamativos. Es de importancia comercial, incluye una especie que se cultiva porque su cápsula contiene goma xantano (X. campestris), que se usa como espesante en muchas áreas industriales (farmacéutica, agroquímica, cosmética, alimenticia...).
Está siendo usada en programas de recuperación secundaria de petróleo, ya que es capaz de reducir la permeabilidad y movilidad del agua donde se ha producido un vertido de petróleo al incrementar su viscosidad.
Bacterias del ácido acético
Todas son α-proteobacterias. Son bacilos GRAM negativos (-), aerobios y móviles. Pueden llevar a cabo la oxidación incompleta de alcoholes y azúcares, lo que provoca la acumulación de ciertos ácidos orgánicos como producto final (como el ácido acético si usan etanol). Presentan una tolerancia relativamente alta a los ácidos (la mayoría puede crecer a pH inferior a 5) lo cual es esencial para organismos que produzcan ácidos.
Son un grupo heterogéneo que incluye organismos con flagelación polar o perítrica. Los que tienen flagelación polar se clasifican dentro del género Gluconobacter, los que tienen flagelación perítrica están englobados en el género Acetobacter. Se diferencian en su capacidad de oxidar posteriormente el acético para generar CO2. Si tienen el ciclo de Krebs completo, como Acetobacter, pueden oxidar completamente el acético. Acetobacter oxida hasta CO2 + H2O mientras que le quede etanol.
Etanol → Acético → CO2 + H2O
O sea, el último paso solo lo puede hacer cuando ya no queda nada o muy poco de etanol.
Gluconobacter tiene el ciclo de Krebs incompleto y no lo pueden realizar (no lo puede oxidar hasta CO2 y agua). Mientras quede alcohol no usan el ácido acético.
Se encuentran en bebidas alcohólicas y se aíslan a menudo de la sidra, el vino o la cerveza. En placas con carbonato cálcico (CaCO3) y etanol se diferencian fácilmente: el acético producido disuelve el carbonato cálcico del medio. Al disolverse se produce un aclaramiento en la placa alrededor de las colonias que hayan producido ácido acético.
Se emplean en la producción de vinagre.
Además de usar el etanol pueden oxidar de manera incompleta otros compuestos orgánicos como alcoholes de cadena larga y azúcares como glucosa. Ésta es oxidada solo hasta glucónico, y la galactosa hasta galactónico. Esta característica suboxidante es aprovechada para la producción del ácido ascórbico (Vitamina C). Ésta es fácil de producir a partir de la sorbosa, y estas bacterias son capaces de convertir el sorbitol hasta sorbosa. Es un proceso de biotransformación.
Otra propiedad bastante interesante es su capacidad de sintetizar celulosa. Esta celulosa no difiere sustancialmente de la de origen vegetal, salvo que es pura y no está mezclada con otros polímeros como hemicelulosa, pectinas o ligninas. No forma parte de la pared celular, sino que forma una matriz externa por fuera de la pared (se observan rodeadas de una maraña de microfibrillas de celulosa). Puede usarse como espesante en alimentos. Cuando se cultivan en medio líquido se crea una película de celulosa. Esta maraña puede suponer una estrategia para estar siempre en contacto con el oxígeno en la superficie de líquido.
Bacterias fijadoras de nitrógeno
Diversos organismos del suelo son fijadores aeróbicos del nitrógeno. Están en 3 clases: α, β o γ proteobacterias.
Azotobacter
Son γ-proteobacterias (gamma), fijadores libres de nitrógeno. Tiene forma de bacilo pleomórfico (forma siempre definida) de gran tamaño (cercano al de las levaduras), de más de 2 a 4 μm, más bien cortos. Son aerobios estrictos y fijan nitrógeno de forma no simbiótica. Algunas cepas son móviles gracias a flagelación perítrica y otras cepas son inmóviles.
Cuando fijan nitrógeno en un medio con carbohidratos, producen unas cápsulas mucosas/mucilaginosas. Realizan respiración aerobia. Su nitrogenasa es sensible al oxígeno, pero representan la tasa respiratoria más elevada de todos los microorganismos: esto está relacionado con la protección de la nitrogenasa, ya que el oxígeno que entra al interior celular rápidamente se reduce a agua y de esta forma se evita que se inactive la nitrogenasa, además de la ayuda de la cápsula mucosa. Además, la nitrogenasa tiene protección conformacional: forma asociaciones con una proteína determinada que la inactiva en presencia de oxígeno.
Pueden formar cistes o quistes. Son formas de resistencia, pero no de latencia como las endosporas. Presentan bajos niveles de respiración endógena, son resistentes a la desecación, rotura mecánica, radiación ultravioleta e ionizante, pero no son particularmente resistentes al calor. No están completamente latentes, si se les suministra una fuente de carbono utilizable, la oxidan rápidamente.
Rhizobium
Son α-proteobacterias aeróbicas. Incluye bacilos móviles con flagelación polar o perítrica según la especie y con un tamaño medio de 0'5-0'9 x 1'2-3 μm. Presentan pleomorfismo en condiciones adversas (cambian de forma).
Crecen en simbiosis en el interior de las células de los nódulos radiculares de las leguminosas. Son muy específicos, una cepa bacteriana puede establecer simbiosis con una determinada especie de leguminosa, pero no con otras. No pueden fijar nitrógeno por separado, necesitan las condiciones microaerófilas que le aporta la planta.
En el nódulo radicular debe de haber unos niveles bajos de oxígeno, que están controlados por la leghemoglobina, una ferroproteína roja que se une al oxígeno. La formación de esta leghemoglobina esta inducida por la interacción de los dos organismos: la parte globina está formada por la planta, y el grupo hemo esta codificado por la bacteria. Podemos considerar que la leghemoglobina actúa a modo de tampón de oxígeno, manteniendo bajo y constante el nivel de oxígeno próximo a la bacteria (condición indispensable para que fije nitrógeno).
Fijan nitrógeno en estado de bacteroide en los nódulos radiculares de leguminosas. El bacteroide así se convierte en microaerófilo.
Formación del nódulo
Reconocimiento y adherencia
El contacto entre la bacteria y la raíz se lleva a cabo por parte de los dos organismos. La planta produce unas lectinas (glicoproteínas que son capaces de aglutinar a las bacterias). Se han identificado tanto en los extremos de los pelos radiculares como en la superficie de las bacterias próximas a las raíces.
Por otra parte, la bacteria lleva a cabo la unión por una porción polisacarídica de la membrana externa de su pared (parte polisacárida del lipopolisacárido). Presentan también unos pili que participan en la unión a los pelos radiculares.
También actúan unas proteínas especiales de unión denominadas ricadhesinas, que se unen a calcio y captan complejos de calcio en la superficie de los pelos radiculares.
Enrrollamiento e invaginación de los pelos radiculares
Debido a unas sustancias denomianas factores Nod (codificadas por los genes Nod, producidos por la bacteria, pero solo en presencia de los flavonoides producidos por la planta) se va a producir el enrollamiento del pelo radicular. Son sustancias producidas por las bacterias, pero inducidas por flavonoides liberados por la raíz de la planta.
Entrada en los pelos radiculares
Las bacterias entran porque inducen la formación por parte de la planta de canales de infección en los pelos radiculares, por donde pasan a través las bacterias.
Invasión y desplazamiento
Las bacterias van avanzando a través de los canales de infección hasta alcanzar células adyacentes a los pelos radiculares. Normalmente éstas son células diploides, y, si la alcanzan, sufren necrosis y degeneran. Pero también pueden alcanzar células tetraploides, activando su división gracias a los factores Nod (producidos por la bacteria). Esto desencadena la formación del nódulo.
O sea, si infectan células diploides, estas van a degenerar y morir, sufriendo necrosis. Pero si infectan células tetraploides se desencadena la formación de nódulos.
Formación de nódulos
Las bacterias comienzan a multiplicarse en el interior de las células tetraploides y sufren unas modificaciones hasta convertirse en bacteroides: formas ramificadas, hinchadas y deformes, que se rodean de forma individual o en pequeños grupos de la membrana celular de la planta. La membrana que rodea a los bacteroides se denomina peribacteroide. Sólo se fija nitrógeno cuando se han formado los bacteroides y se han rodeado de la membrana peribacteroide. Se denomina entonces simbiosoma (bacteroide + peribacteroide), que pueden ser individuales o estar dispuestos en pequeños grupos.
Cuando la planta muere, los nódulos se deterioran y parte de esas bacterias pasan al suelo. Cuando las bacterias se encuentran en estado de bacteroide no pueden dividirse, pero siempre dentro de esos grupos habrá alguna bacteria que no se habrá convertido a bacteroide y estará de forma latente. Estas sí que pueden proliferar en el suelo e iniciar la infección de otras raíces cercanas.
Fijación bioquímica del nitrógeno
La fijación se realiza desde nitrógeno atmosférico hasta amoníaco.
En este caso, la reacción se realiza única y exclusivamente en el simbiosoma. Las nitrogenasas se encuentran siempre en el interior del bacteroide. El bacteroide es totalmente dependiente de la planta para fijar nitrógeno, ya que ésta reduce la presión parcial de oxígeno: la leghemoglobina se combina con el oxígeno para evitar que entre en contacto con la nitrogenasa. La planta le suministra nutrientes, principalmente intermediarios del ciclo TCA (succinato, malato, fumarato) los cuales serán donadores de electrones en última instancia para la obtención de ATP y para la propia reacción de la nitrogenasa (que requiere ATP + poder reductor).
La bacteria le suministra el nitrógeno asimilado. El primer producto estable es el amoníaco que puede formar parte de aminoácidos o se puede convertir en glutamina por la glutamina-sintasa: la concentración de glutamina-sintasa en el interior del bacteroide es baja, pero en la célula vegetal adyacente es elevada, por lo que en la planta pasará rápidamente de amoníaco a glutamina. La planta sintetiza amidas, ureidos, a partir de la incorporación del amoníaco.
Factores Nod
Los genes responsables de la formación del nódulo en la bacteria, los genes Nod, se encuentran en unos plásmidos de gran tamaño denominados plásmidos Sym. En ocasiones están rodeados de genes Nif donde está codificada la nitrogenasa.
En algunos casos lo genes Nif se encuentran en el cromosoma, no en el plásmido. Algunos de los plásmidos Sym son responsables de la especificad de las cepas bacterianas para establecer simbiosis con determinadas plantas de leguminosas, formando los denominados grupos de inoculación cruzada, que son cepas de Rhizobium que pueden infectar a un grupo de especies próximas de leguminosas. Las transferencias de estos plásmidos permiten que cepas que no puedan infectar ahora sí lo puedan hacer.
Los factores Nod, dependiendo de las especies tienen variaciones en las cadenas laterales.
Las proteobacterias quimiolitótrofas usan compuestos inorgánicos reducidos como fuente de poder reductor y energía, mientras que las bacterias metanótrofas usan el metano como fuente de carbono y energía.
Pero antes de entrar en estos grupos hablemos de las proteobacterias. Las proteobacterias se caracterizan por su gran diversidad de formas. El sufijo proteo- se origina del dios griego Proteo, o Proteus, que cambiaba de forma. Todas son GRAM negativas (-).
Son el mayor y más diverso grupo de las bacterias, desde el punto morfológico, metabólico y fisiológico. Comprende la mayoría de las bacterias conocidas con importancia médica agrícola o industrial. Muestran una enorme diversidad de mecanismos de generación de energía.
Existen 5 clases de proteobacterias: alfa, beta, gamma, delta y épsilon proteobacterias. Los miembros de las diferentes clases presentan a menudo rasgos fenotípicos comunes, como las proteobacterias quimiolitótrofas (que están en todos los grupos).
Índice de contenidos
Proteobacterias quimiolitótrofas
Usan compuestos inorgánicos reducidos como fuente de energía y poder reductor. Son autótrofos en la mayoría de casos (fijan el CO2 por el ciclo de Calvin). En la siguiente tabla podemos ver la producción de energía a partir de la oxidación de donadores de electrones inorgánicos, un resumen de las bacterias quimiolitótrofas (QLT).
Podemos ver, respecto al diferente tipo de bacterias quimiolitótrofas, su donador de electrones (De), su productor oxidado (POx), su aceptor terminal de electrones (ATE), la reacción que produce energía, su E0' (V), y su ∆G0′ (kJ/ reacción).
| Bacterias QLT | De- | POx. | ATE | Reacción | E0' (V) | ∆G0′ |
|---|---|---|---|---|---|---|
| Oxidantes del hidrógeno | H2 | H2O | O2, NO3-* | H2 + 1/2 O2 → H2O | -0.42 | -237.2 |
| Carboxidotróficas | CO | CO2 | O2 | CO + 1/2 O2 → CO2 | ||
| Oxidantes del azufre | H2S, S0, S2O32- | SO42- | O2, NO3-* | HS- + H+ + 1/2 O2 → S0 + H2O S0 + 1 1/2 O2 + H2O → SO42- + 2 H+ | -0.27 -0.20 | -209.4 -587.1 |
| Oxidantes del hierro | Fe2+ | Fe3+ | O2 | Fe2+ + H+ + 1/2 O2 → Fe3+ + 1/2 H2O | +0.77 | -32.9 |
| Nitrosoficantes (amonio) | NH4+ | NO2- | O2 | NH4+ + 1 1/2 O2 → NO2- + 2 H+ + H2O | +0.34 | -274.7 |
| Nitrificantes (nitrito) | NO2- | NO3- | O2 | NO2- + 1/2 O2 → NO3- | +0.43 | -74.1 |
*NO3- puede ser aceptor terminal de electrones en oxidantes de hidrógeno y azufre en algunas ocasiones, pero no es lo común.
Bacterias oxidantes del hidrógeno
No se encuentran en un grupo particular; de hecho, hay bacterias oxidantes del hidrógeno fuera de las proteobacterias. No constituyen un grupo taxonómico concreto, ya que las hay tanto GRAM positivas (+) (especies quimiolitótrofas como Arthrobacter) como GRAM negativas (-) (proteobacterias, como Paracoccus y Ralstonia, y no proteobacterias).
Son especies de determinados géneros quimiolitótrofos.
Hydrogenobacter
La única quimiolitótrofa estricta oxidante del hidrógeno es Hydrogenobacter, que es un bacilo alargado e inmóvil no proteobacteria, GRAM(-), relacionado filogenéticamente con Aquifex. Hydrogenobacter comprende pocas especies.

Todas las especies restantes oxidantes del H2 son quimiolitótrofas facultativas, pueden oxidar el H2 a falta de un compuesto orgánico que puedan oxidar. Si disponen de un compuesto orgánico lo oxidan; sino usan el H2. Algunas son mixótrofas (quimiolitoheterótrofas) ya que nunca pueden fijar el CO2; siempre tienen que utilizar un compuesto orgánico como fuente de C. Otras son quimiolitoautótrofas facultativas: pueden fijar el CO2 si no disponen del compuesto orgánico adecuado a través del ciclo de Calvin.
La mayoría son microaerófilas porque los enzimas para la oxidación del H2, las hidrogenasas, son sensibles a las altas presiones de oxígeno. Además, algunas fijan N2 y tienen nitrogenasa, que también es sensible al oxígeno. Si pasarán a una ppO2 superior, pasarían a ser quimioheterótrofas y de dejarían de usar el H2.
Hidrogenasas
En general, las bacterias oxidantes del hidrógeno pueden tener una o varias hidrogenasas. La ligada a la membrana puede estar especializada en la síntesis de ATP, mientras que la hidrogenasa soluble en la fijación de CO2 junto con el ATP en el citosol.
Pueden contener dos tipos de hidrogenasa: una particulada (como Paracoccus denitrificans) o una soluble. Rastonia eutropha posee ambos tipos de hidrogenasa.
Las que poseen ambas hidrogenasas crecen más rápido que aquellas que solo tienen una: con una podrían permitirse el crecimiento a expensas de N2 sin que estuviera la soluble, pero gastando energía. La ventaja selectiva de producir dos hidrogenasas se basa en las actividades diferenciales de ambas a distintas concentraciones de hidrogeno: si la ppH2 es baja, la reacción se desvía hacia la izquierda; en estas condiciones, trabajará la particulada proporcionando los electrones para sintetizar ATP y reducir NAD por transporte inverso de electrones. Si la ppH2 es alta, la reacción se desvía hacia la derecha, y en estas condiciones trabajará la soluble, evitando el gasto de energía que supone obtener el poder reductor por medio de la hidrogenasa (por transporte inverso de electrones).
Si la ppH2 es alta, la hidrogenasa soluble evita el gasto de energía para formar NADH por transporte inverso de electrones, mientras que si la ppH2 es baja, la hidrogenasa particulada proporciona electrones para sintetizar ATP. La hidrogenasa soluble parece ser una adaptación específica a crecimiento a presiones parciales de hidrógeno altas.
Carboxidobacterias
Algunas oxidantes de H2 pueden crecer con CO como donador de electrones; son carboxidobacterias, como Pseudomonas carboxydovorans. Tiene como enzima clave la deshidrogenasa del monóxido de carbono, y van a emplear el CO2 generado como punto de partida para el ciclo de Calvin. El consumo de CO por parte de estas bacterias es de relevancia ecológica, ya que, aunque se genera mucho por parte de los humanos, la cantidad de CO no ha amentado por la proliferación de este tipo de bacterias.
Oxidan el CO - generan CO2 - fijan CO2
La liberación mayor del CO ocurre en ambientes aerobios como consecuencia de los gases de escape de automóviles, combustibles fósiles y metabolismo de la lignina. Estas bacterias en las capas superiores del suelo representan el principal sumidero de CO en la naturaleza. Se las califica quimiolitótrofas facultativas. Todas son oxidantes del hidrógeno.
Bacterias oxidantes de azufre y hierro
A estas bacterias se las conoce también como incoloras del S para diferenciarlas de las fotótrofas rojas y verdes del azufre. Usan compuestos reducidos del azufre como fuente de energía y poder reductor. La capacidad de crecer quimiolitrotróficamente a partir de compuestos del azufre (S) no es exclusiva de estas bacterias, porque también lo hace Sulfolobus (arquea).
La mayoría de los oxidantes del S son acidófilos como Acidithiobacillus ferrooxidans, porque al oxidar esos compuestos reducidos del azufre se obtiene sulfato, y, si hay protones, se produce ácido sulfúrico, por lo que baja el pH del medio; ello implica que sean acidófilas.

También hay algunas neutrófilas, por lo que se distinguen dos clases ecológicamente distintas:
- Neutrófilas.
- Acidófilas. Son la mayoría. También pueden usar compuestos reducidos del hierro como fuente de poder reductor. Su pH óptimo oscila entre 2 y 4. Aquí entra Acidithiobacillus ferrooxidans.
Algunas son quimiolitoautótrofas estrictas: fijan el CO2 por el ciclo de Calvin (los que son autótrofos siempre fijan por el ciclo de Calvin). Aunque hay algunas que son quimiolitoautótrofas facultativas, que en ocasiones pueden funcionar como quimioorganótrofas (emplean compuestos reducidos de S pero también el azufre orgánico). En presencia del orgánico usaran en orgánico y no el compuesto de S.
Otras son mixótrofas (quimiolitoheterótrofo) emplean compuestos reducidos de S y su fuente de carbono, como Beggiatoa y Thiothrix. No fijan CO2 ni tienen ciclo de Calvin.
No todas son aerobias estrictas: hay otras anaerobias facultativas, que usan el nitrato como aceptor final de electrones en vez del oxígeno, como Thiobacillus denitrificans.
Thiobacillus
El género Thiobacillus está dentro de las alfa, beta y gamma proteobacterias; presenta especies muy distribuidas entre las proteobacterias. Son bacilos pequeños con flagelación polar. Oxidan los compuestos reducidos de azufre, formando azufre (S0) que depositan fuera de la célula (depósito extracelular).
Beggiatoa
El género Beggiatoa está dentro de las gamma proteobacterias. Son filamentosas, cilíndricas y deslizantes, con filamentos largos y anchos. Es habitual que se entremezclen y formen mechones bastante complejos.

La mayoría de las especies son mixótrofas (necesitan un compuesto orgánico para la fuente de C). Son microaerófilas. En este caso, el azufre se deposita dentro de la célula.

Su hábitat son las aguas residuales, arrozales, lodos, salinas, ambientes polucionados; en general, ambientes ricos en azufre o sulfhídrico. En el fango del arroz pueden aparecer zonas anóxicas en las que pueden desarrollarse bacterias sulfato-reductoras que producen sulfhídrico del que se beneficia Beggiatoa, de manera que establece simbiosis con la planta del arroz para que no dañe el sulfhídrico a la planta. La bacteria se beneficia del oxígeno que la planta transporta a la litosfera ya que en esos fangos la presión parcial de oxigeno es muy baja.
Pueden causar alteraciones en las plantas de tratamiento de agua residual. Al ser filamentosas suelen ser floculantes (no tienden a precipitar) y provocan engrosamiento, desplazando a la flora habitual de estos residuos. El agua no queda tratada.
Thiothrix
El género Thiothrix es una gamma proteobacteria. Con filamentos envainados, esta bacteria es mixótrofa y aerobia. Se agrupa formando rosetas. Las rosetas se agrupan por los filamentos, ya que se segrega un disco adhesivo por el filamento que les permite seguir agregados formando esas estructuras.
a. Roseta.
b. Gonidios.
c. Envoltura o vaina
Fuente: Mardanov A. V. et al., (2020)
De esos extremos de los filamentos contrarios a los que están adheridos se liberan gonidios, formas de reproducción asexual, formas de dispersión apicales que se liberan de un extremo y diferentes morfológicamente del resto del filamento.
Se encuentra en aguas polucionadas residuales y en corrientes de agua ricas en azufre. Al ser mixótrofo requiere compuestos reducidos de S y compuestos orgánicos como fuente de C. Ese azufre se depositaria dentro de la célula y le da aspecto refringente.
Bacterias nitrificantes
En este grupo aparecen alfa, beta y gamma-proteobacterias. Son las primeras en los que se demostró el crecimiento quimiolitotrófico descubierto por Winosgrasky. Las nitrificantes utilizan compuestos inorgánicos de nitrógeno como fuente de energía y poder reductor. Hay dos grupos:
- Las que utilizan el amoniaco y lo oxidan hasta nitrito. Son las nitrosoficantes.
- Las que oxidan de nitrito hasta nitrato. Son las nitrificantes.
Tienen transporte inverso de electrones. La mayoría son quimiolitoautótrofas estrictas, y fijan el CO2 por el ciclo de Calvin. Son bacterias aerobias estrictas. Tanto las nitrosoficantes, pero en mayor medida las nitrificantes, obtienen poca energía de la utilización de compuestos nitrogenados, por lo que su crecimiento es lento (bajo rendimiento energético/ crecimiento). Esto se debe a que sufren transporte inverso de electrones.
Una excepción es Nitrobacter que puede crecer como quimioheterótrofo. En la naturaleza no hay grupos microbianos que lleven la oxidación completa de amoniaco a nitrato. Se realiza esa oxidación por la acción secuencial de dos grupos distintos: los nitrosoficantes y nitrificantes. Los nitrosificantes pasan de amonio a nitrato y son Nitrosomonas y Nitrosococcus. Las nitrificantes (nitrito a nitrato) corresponden a Nitrobacter. Tienen membranas parecidas a las bacterias rojas (están relacionadas filogenéticamente) donde se localizan los enzimas clave de la nitrificación (amonio monooxigenasa - AMO en Nitrosomonas / nitrito oxidorreductasa - NXR en Nitrobacter).

Estas bacterias están en suelos y aguas, muy distribuidas pero rara vez en grandes cantidades (solo en ambientes con abundante NH3). Son muy abundantes en ambientes donde abunde el amoníaco; por ejemplo, donde exista una gran descomposición de proteínas o en aguas residuales tratadas con amoniaco. También podemos encontrarlas en lagos estratificados (en la parte inferior de la región aerobia).
Son muy importantes en el ciclo del nitrógeno. Las nitrificantes son importantes en el tratamiento de aguas residuales (retiran aminas, amoniaco, que transforman en nitrato).
Proteobacterias metanótrofas y metilótrofas
Constituyen las llamadas bacterias metófilas. Ambos grupos usan compuestos con un átomo de carbono. Las metanótrofas pueden emplear el metano mientras que las metilótrofas no lo pueden emplear. Eso sí, ambas pueden usar compuestos de dos carbonos siempre que no estén enlazados (C-C).
Entre las metilótrofas hay que diferenciar las que podemos considerar obligadas, restrictivas y facultativas. Todas usan compuestos de 1C menos el metano. Pueden usar metanol, como por ejemplo Methylophilus, beta-proteobacteria. Las restrictivas usan también algunos compuestos con 2C, pero pocos. Las facultativas pueden usar incluso un azúcar o metanol.
En la naturaleza el compuesto C1 más común es el metano, que es estable. El metanol puede proceder de la rotura de las pectinas de paredes vegetales.
Todas, tanto metanótrofas como metilótrofas pueden utilizar el metanol o el formaldehido, pero no pueden usar el fórmico, aunque lo van a formar en el proceso de oxidación. En cuanto al metano, lo característico de metanótrofas es que lo usan como fuente de energía y poder reductor.
Emplean una enzima, la llamada MMO (metano mono-oxigenasa), que pasa el metano a metanol, y pasa finalmente a fórmico. Producen CO2. La MMO introduce una molécula de oxígeno y libera agua para pasar de metano a metanol.
Son catalasa+/ oxidasa+, así que respecto a su metabolismo respiratorio podemos decir que son aerobios estrictos. Ahora bien, algunas cepas son microaerófilas y pueden fijar N2 de forma especial.
Son también especiales porque poseen esteroles que son extraños o inusuales en el caso de los procariotas. Solo hay esteroles en micoplasmas y metanótrofas. Tienen sistemas internos de membranas donde se encuentra la MMO.
Clasificación de los metanótrofos
Los metanótrofos se pueden clasificar en dos tipos, por la disposición de esos sistemas internos de membrana entre otras cosas:
- Tipo I. Son gamma-proteobacterias que pueden fijar el nitrógeno o no. Las membranas tienen forma de vesículas compactas. Producen cistes y asimilan el carbono por la ruta del monofosfato de ribulosa (RuMP). Su ciclo de Krebs es incompleto, ya que carecen de α-cetoglutarato deshidrogenasa (αcetoGluDHasa). Ejemplo: Methylococcus.
- Tipo II. Son alfa-proteobacterias que siempre fijan el nitrógeno. Las membranas son laminillas periféricas paralelas a la superficie. Producen exosportas o cistes, y asimilan el carbono por la ruta de la serina. Su ciclo de Krebs es completo. Ejemplo: Methylosinus.
Las del tipo I presentan cistes como células de reposo, que son como formas de dispersión en los que la célula se va esterificando y se va agrandando por la incorporación de capas adicionales externas. En el tipo II, algunas producen cistes y otras exosporas como Methylosinus. Una vez que se forma la exospora la célula parental muere.
Las metanótrofas están en ambientes con oxígeno y donde haya metano. Tienen un importante papel en el ciclo del C, ya que transforman el metano procedente de la descomposición anaerobia en material celular y dióxido de carbono.
Estas bacterias son fáciles de identificar a la hora de hacer un cultivo porque forman estructuras rosadas por la presencia de carotenoides.
Pueden proceder de las nitrosoficantes, de Nitrosoccocus, que por mutación de la amoníaco monooxigenasa se transformara en MMO, porque las que tienen MMO también pueden usar como sustrato amoníaco y lo pueden oxidar en principio pero de ahí no obtienen energía y puede llegar a ser toxico si se acopla y no produce energía.
Bibliografía de imágenes
Mardanov, A. V., Gruzdev, E. V., Smolyakov, D. D., Rudenko, T. S., Beletsky, A. V., Gureeva, M. V., Markov, N. D., Berestovskaya, Y. Y., Pimenov, N. V., Ravin, N. V., & Grabovich, M. Y. (2020). Genomic and Metabolic Insights into Two Novel Thiothrix Species from Enhanced Biological Phosphorus Removal Systems. Microorganisms, 8(12), 2030. https://doi.org/10.3390/microorganisms8122030
Rudenko, T. S., Tarlachkov, S. V., Shatskiy, N. D., & Grabovich, M. Y. (2020). Comparative Genomics of Beggiatoa leptomitoformis Strains D-401 and D-402T with Contrasting Physiology but Extremely High Level of Genomic Identity. Microorganisms, 8(6), 928. https://doi.org/10.3390/microorganisms8060928
Zeytun, A., Sikorski, J., Nolan, M., Lapidus, A., Lucas, S., Han, J., Tice, H., Cheng, J. F., Tapia, R., Goodwin, L., Pitluck, S., Liolios, K., Ivanova, N., Mavromatis, K., Mikhailova, N., Ovchinnikova, G., Pati, A., Chen, A., Palaniappan, K., Ngatchou-Djao, O. D., … Kyrpides, N. C. (2011). Complete genome sequence of Hydrogenobacter thermophilus type strain (TK-6). Standards in genomic sciences, 4(2), 131–143. https://doi.org/10.4056/sigs.1463589
Zhang, Y., Zhang, S., Zhao, D., Ni, Y., Wang, W., & Yan, L. (2019). Complete Genome Sequence of Acidithiobacillus Ferrooxidans YNTRS-40, a Strain of the Ferrous Iron- and Sulfur-Oxidizing Acidophile. Microorganisms, 8(1), 2. https://doi.org/10.3390/microorganisms8010002
Zhang, Y., Zhang, Y., Gao, J., Shen, Q., Bai, Z., Zhuang, X., & Zhuang, G. (2018). Optimization of the medium for the growth of Nitrobacter winogradskyi by statistical method. Letters in applied microbiology, 67(3), 306–313. https://doi.org/10.1111/lam.13036
