
Proteobacterias quimiolitótrofas y metanótrofas
Las proteobacterias quimiolitótrofas usan compuestos inorgánicos reducidos como fuente de poder reductor y energía, mientras que las bacterias metanótrofas usan el metano como fuente de carbono y energía.
Pero antes de entrar en estos grupos hablemos de las proteobacterias. Las proteobacterias se caracterizan por su gran diversidad de formas. El sufijo proteo- se origina del dios griego Proteo, o Proteus, que cambiaba de forma. Todas son GRAM negativas (-).
Son el mayor y más diverso grupo de las bacterias, desde el punto morfológico, metabólico y fisiológico. Comprende la mayoría de las bacterias conocidas con importancia médica agrícola o industrial. Muestran una enorme diversidad de mecanismos de generación de energía.
Existen 5 clases de proteobacterias: alfa, beta, gamma, delta y épsilon proteobacterias. Los miembros de las diferentes clases presentan a menudo rasgos fenotípicos comunes, como las proteobacterias quimiolitótrofas (que están en todos los grupos).
Índice de contenidos
Proteobacterias quimiolitótrofas
Usan compuestos inorgánicos reducidos como fuente de energía y poder reductor. Son autótrofos en la mayoría de casos (fijan el CO2 por el ciclo de Calvin). En la siguiente tabla podemos ver la producción de energía a partir de la oxidación de donadores de electrones inorgánicos, un resumen de las bacterias quimiolitótrofas (QLT).
Podemos ver, respecto al diferente tipo de bacterias quimiolitótrofas, su donador de electrones (De), su productor oxidado (POx), su aceptor terminal de electrones (ATE), la reacción que produce energía, su E0' (V), y su ∆G0′ (kJ/ reacción).
| Bacterias QLT | De- | POx. | ATE | Reacción | E0' (V) | ∆G0′ |
|---|---|---|---|---|---|---|
| Oxidantes del hidrógeno | H2 | H2O | O2, NO3-* | H2 + 1/2 O2 → H2O | -0.42 | -237.2 |
| Carboxidotróficas | CO | CO2 | O2 | CO + 1/2 O2 → CO2 | ||
| Oxidantes del azufre | H2S, S0, S2O32- | SO42- | O2, NO3-* | HS- + H+ + 1/2 O2 → S0 + H2O S0 + 1 1/2 O2 + H2O → SO42- + 2 H+ | -0.27 -0.20 | -209.4 -587.1 |
| Oxidantes del hierro | Fe2+ | Fe3+ | O2 | Fe2+ + H+ + 1/2 O2 → Fe3+ + 1/2 H2O | +0.77 | -32.9 |
| Nitrosoficantes (amonio) | NH4+ | NO2- | O2 | NH4+ + 1 1/2 O2 → NO2- + 2 H+ + H2O | +0.34 | -274.7 |
| Nitrificantes (nitrito) | NO2- | NO3- | O2 | NO2- + 1/2 O2 → NO3- | +0.43 | -74.1 |
*NO3- puede ser aceptor terminal de electrones en oxidantes de hidrógeno y azufre en algunas ocasiones, pero no es lo común.
Bacterias oxidantes del hidrógeno
No se encuentran en un grupo particular; de hecho, hay bacterias oxidantes del hidrógeno fuera de las proteobacterias. No constituyen un grupo taxonómico concreto, ya que las hay tanto GRAM positivas (+) (especies quimiolitótrofas como Arthrobacter) como GRAM negativas (-) (proteobacterias, como Paracoccus y Ralstonia, y no proteobacterias).
Son especies de determinados géneros quimiolitótrofos.
Hydrogenobacter
La única quimiolitótrofa estricta oxidante del hidrógeno es Hydrogenobacter, que es un bacilo alargado e inmóvil no proteobacteria, GRAM(-), relacionado filogenéticamente con Aquifex. Hydrogenobacter comprende pocas especies.

Todas las especies restantes oxidantes del H2 son quimiolitótrofas facultativas, pueden oxidar el H2 a falta de un compuesto orgánico que puedan oxidar. Si disponen de un compuesto orgánico lo oxidan; sino usan el H2. Algunas son mixótrofas (quimiolitoheterótrofas) ya que nunca pueden fijar el CO2; siempre tienen que utilizar un compuesto orgánico como fuente de C. Otras son quimiolitoautótrofas facultativas: pueden fijar el CO2 si no disponen del compuesto orgánico adecuado a través del ciclo de Calvin.
La mayoría son microaerófilas porque los enzimas para la oxidación del H2, las hidrogenasas, son sensibles a las altas presiones de oxígeno. Además, algunas fijan N2 y tienen nitrogenasa, que también es sensible al oxígeno. Si pasarán a una ppO2 superior, pasarían a ser quimioheterótrofas y de dejarían de usar el H2.
Hidrogenasas
En general, las bacterias oxidantes del hidrógeno pueden tener una o varias hidrogenasas. La ligada a la membrana puede estar especializada en la síntesis de ATP, mientras que la hidrogenasa soluble en la fijación de CO2 junto con el ATP en el citosol.
Pueden contener dos tipos de hidrogenasa: una particulada (como Paracoccus denitrificans) o una soluble. Rastonia eutropha posee ambos tipos de hidrogenasa.
Las que poseen ambas hidrogenasas crecen más rápido que aquellas que solo tienen una: con una podrían permitirse el crecimiento a expensas de N2 sin que estuviera la soluble, pero gastando energía. La ventaja selectiva de producir dos hidrogenasas se basa en las actividades diferenciales de ambas a distintas concentraciones de hidrogeno: si la ppH2 es baja, la reacción se desvía hacia la izquierda; en estas condiciones, trabajará la particulada proporcionando los electrones para sintetizar ATP y reducir NAD por transporte inverso de electrones. Si la ppH2 es alta, la reacción se desvía hacia la derecha, y en estas condiciones trabajará la soluble, evitando el gasto de energía que supone obtener el poder reductor por medio de la hidrogenasa (por transporte inverso de electrones).
Si la ppH2 es alta, la hidrogenasa soluble evita el gasto de energía para formar NADH por transporte inverso de electrones, mientras que si la ppH2 es baja, la hidrogenasa particulada proporciona electrones para sintetizar ATP. La hidrogenasa soluble parece ser una adaptación específica a crecimiento a presiones parciales de hidrógeno altas.
Carboxidobacterias
Algunas oxidantes de H2 pueden crecer con CO como donador de electrones; son carboxidobacterias, como Pseudomonas carboxydovorans. Tiene como enzima clave la deshidrogenasa del monóxido de carbono, y van a emplear el CO2 generado como punto de partida para el ciclo de Calvin. El consumo de CO por parte de estas bacterias es de relevancia ecológica, ya que, aunque se genera mucho por parte de los humanos, la cantidad de CO no ha amentado por la proliferación de este tipo de bacterias.
Oxidan el CO - generan CO2 - fijan CO2
La liberación mayor del CO ocurre en ambientes aerobios como consecuencia de los gases de escape de automóviles, combustibles fósiles y metabolismo de la lignina. Estas bacterias en las capas superiores del suelo representan el principal sumidero de CO en la naturaleza. Se las califica quimiolitótrofas facultativas. Todas son oxidantes del hidrógeno.
Bacterias oxidantes de azufre y hierro
A estas bacterias se las conoce también como incoloras del S para diferenciarlas de las fotótrofas rojas y verdes del azufre. Usan compuestos reducidos del azufre como fuente de energía y poder reductor. La capacidad de crecer quimiolitrotróficamente a partir de compuestos del azufre (S) no es exclusiva de estas bacterias, porque también lo hace Sulfolobus (arquea).
La mayoría de los oxidantes del S son acidófilos como Acidithiobacillus ferrooxidans, porque al oxidar esos compuestos reducidos del azufre se obtiene sulfato, y, si hay protones, se produce ácido sulfúrico, por lo que baja el pH del medio; ello implica que sean acidófilas.

También hay algunas neutrófilas, por lo que se distinguen dos clases ecológicamente distintas:
- Neutrófilas.
- Acidófilas. Son la mayoría. También pueden usar compuestos reducidos del hierro como fuente de poder reductor. Su pH óptimo oscila entre 2 y 4. Aquí entra Acidithiobacillus ferrooxidans.
Algunas son quimiolitoautótrofas estrictas: fijan el CO2 por el ciclo de Calvin (los que son autótrofos siempre fijan por el ciclo de Calvin). Aunque hay algunas que son quimiolitoautótrofas facultativas, que en ocasiones pueden funcionar como quimioorganótrofas (emplean compuestos reducidos de S pero también el azufre orgánico). En presencia del orgánico usaran en orgánico y no el compuesto de S.
Otras son mixótrofas (quimiolitoheterótrofo) emplean compuestos reducidos de S y su fuente de carbono, como Beggiatoa y Thiothrix. No fijan CO2 ni tienen ciclo de Calvin.
No todas son aerobias estrictas: hay otras anaerobias facultativas, que usan el nitrato como aceptor final de electrones en vez del oxígeno, como Thiobacillus denitrificans.
Thiobacillus
El género Thiobacillus está dentro de las alfa, beta y gamma proteobacterias; presenta especies muy distribuidas entre las proteobacterias. Son bacilos pequeños con flagelación polar. Oxidan los compuestos reducidos de azufre, formando azufre (S0) que depositan fuera de la célula (depósito extracelular).
Beggiatoa
El género Beggiatoa está dentro de las gamma proteobacterias. Son filamentosas, cilíndricas y deslizantes, con filamentos largos y anchos. Es habitual que se entremezclen y formen mechones bastante complejos.

La mayoría de las especies son mixótrofas (necesitan un compuesto orgánico para la fuente de C). Son microaerófilas. En este caso, el azufre se deposita dentro de la célula.

Su hábitat son las aguas residuales, arrozales, lodos, salinas, ambientes polucionados; en general, ambientes ricos en azufre o sulfhídrico. En el fango del arroz pueden aparecer zonas anóxicas en las que pueden desarrollarse bacterias sulfato-reductoras que producen sulfhídrico del que se beneficia Beggiatoa, de manera que establece simbiosis con la planta del arroz para que no dañe el sulfhídrico a la planta. La bacteria se beneficia del oxígeno que la planta transporta a la litosfera ya que en esos fangos la presión parcial de oxigeno es muy baja.
Pueden causar alteraciones en las plantas de tratamiento de agua residual. Al ser filamentosas suelen ser floculantes (no tienden a precipitar) y provocan engrosamiento, desplazando a la flora habitual de estos residuos. El agua no queda tratada.
Thiothrix
El género Thiothrix es una gamma proteobacteria. Con filamentos envainados, esta bacteria es mixótrofa y aerobia. Se agrupa formando rosetas. Las rosetas se agrupan por los filamentos, ya que se segrega un disco adhesivo por el filamento que les permite seguir agregados formando esas estructuras.
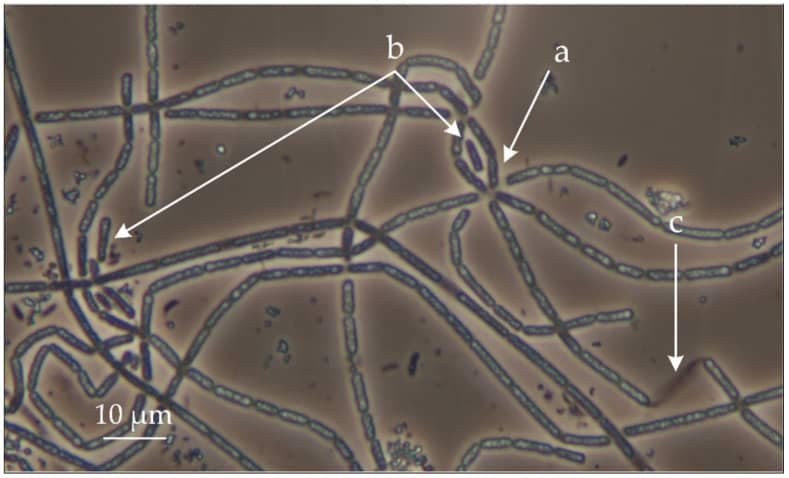
a. Roseta.
b. Gonidios.
c. Envoltura o vaina
Fuente: Mardanov A. V. et al., (2020)
De esos extremos de los filamentos contrarios a los que están adheridos se liberan gonidios, formas de reproducción asexual, formas de dispersión apicales que se liberan de un extremo y diferentes morfológicamente del resto del filamento.
Se encuentra en aguas polucionadas residuales y en corrientes de agua ricas en azufre. Al ser mixótrofo requiere compuestos reducidos de S y compuestos orgánicos como fuente de C. Ese azufre se depositaria dentro de la célula y le da aspecto refringente.
Bacterias nitrificantes
En este grupo aparecen alfa, beta y gamma-proteobacterias. Son las primeras en los que se demostró el crecimiento quimiolitotrófico descubierto por Winosgrasky. Las nitrificantes utilizan compuestos inorgánicos de nitrógeno como fuente de energía y poder reductor. Hay dos grupos:
- Las que utilizan el amoniaco y lo oxidan hasta nitrito. Son las nitrosoficantes.
- Las que oxidan de nitrito hasta nitrato. Son las nitrificantes.
Tienen transporte inverso de electrones. La mayoría son quimiolitoautótrofas estrictas, y fijan el CO2 por el ciclo de Calvin. Son bacterias aerobias estrictas. Tanto las nitrosoficantes, pero en mayor medida las nitrificantes, obtienen poca energía de la utilización de compuestos nitrogenados, por lo que su crecimiento es lento (bajo rendimiento energético/ crecimiento). Esto se debe a que sufren transporte inverso de electrones.
Una excepción es Nitrobacter que puede crecer como quimioheterótrofo. En la naturaleza no hay grupos microbianos que lleven la oxidación completa de amoniaco a nitrato. Se realiza esa oxidación por la acción secuencial de dos grupos distintos: los nitrosoficantes y nitrificantes. Los nitrosificantes pasan de amonio a nitrato y son Nitrosomonas y Nitrosococcus. Las nitrificantes (nitrito a nitrato) corresponden a Nitrobacter. Tienen membranas parecidas a las bacterias rojas (están relacionadas filogenéticamente) donde se localizan los enzimas clave de la nitrificación (amonio monooxigenasa - AMO en Nitrosomonas / nitrito oxidorreductasa - NXR en Nitrobacter).

Estas bacterias están en suelos y aguas, muy distribuidas pero rara vez en grandes cantidades (solo en ambientes con abundante NH3). Son muy abundantes en ambientes donde abunde el amoníaco; por ejemplo, donde exista una gran descomposición de proteínas o en aguas residuales tratadas con amoniaco. También podemos encontrarlas en lagos estratificados (en la parte inferior de la región aerobia).
Son muy importantes en el ciclo del nitrógeno. Las nitrificantes son importantes en el tratamiento de aguas residuales (retiran aminas, amoniaco, que transforman en nitrato).
Proteobacterias metanótrofas y metilótrofas
Constituyen las llamadas bacterias metófilas. Ambos grupos usan compuestos con un átomo de carbono. Las metanótrofas pueden emplear el metano mientras que las metilótrofas no lo pueden emplear. Eso sí, ambas pueden usar compuestos de dos carbonos siempre que no estén enlazados (C-C).
Entre las metilótrofas hay que diferenciar las que podemos considerar obligadas, restrictivas y facultativas. Todas usan compuestos de 1C menos el metano. Pueden usar metanol, como por ejemplo Methylophilus, beta-proteobacteria. Las restrictivas usan también algunos compuestos con 2C, pero pocos. Las facultativas pueden usar incluso un azúcar o metanol.
En la naturaleza el compuesto C1 más común es el metano, que es estable. El metanol puede proceder de la rotura de las pectinas de paredes vegetales.
Todas, tanto metanótrofas como metilótrofas pueden utilizar el metanol o el formaldehido, pero no pueden usar el fórmico, aunque lo van a formar en el proceso de oxidación. En cuanto al metano, lo característico de metanótrofas es que lo usan como fuente de energía y poder reductor.
Emplean una enzima, la llamada MMO (metano mono-oxigenasa), que pasa el metano a metanol, y pasa finalmente a fórmico. Producen CO2. La MMO introduce una molécula de oxígeno y libera agua para pasar de metano a metanol.
Son catalasa+/ oxidasa+, así que respecto a su metabolismo respiratorio podemos decir que son aerobios estrictos. Ahora bien, algunas cepas son microaerófilas y pueden fijar N2 de forma especial.
Son también especiales porque poseen esteroles que son extraños o inusuales en el caso de los procariotas. Solo hay esteroles en micoplasmas y metanótrofas. Tienen sistemas internos de membranas donde se encuentra la MMO.
Clasificación de los metanótrofos
Los metanótrofos se pueden clasificar en dos tipos, por la disposición de esos sistemas internos de membrana entre otras cosas:
- Tipo I. Son gamma-proteobacterias que pueden fijar el nitrógeno o no. Las membranas tienen forma de vesículas compactas. Producen cistes y asimilan el carbono por la ruta del monofosfato de ribulosa (RuMP). Su ciclo de Krebs es incompleto, ya que carecen de α-cetoglutarato deshidrogenasa (αcetoGluDHasa). Ejemplo: Methylococcus.
- Tipo II. Son alfa-proteobacterias que siempre fijan el nitrógeno. Las membranas son laminillas periféricas paralelas a la superficie. Producen exosportas o cistes, y asimilan el carbono por la ruta de la serina. Su ciclo de Krebs es completo. Ejemplo: Methylosinus.
Las del tipo I presentan cistes como células de reposo, que son como formas de dispersión en los que la célula se va esterificando y se va agrandando por la incorporación de capas adicionales externas. En el tipo II, algunas producen cistes y otras exosporas como Methylosinus. Una vez que se forma la exospora la célula parental muere.
Las metanótrofas están en ambientes con oxígeno y donde haya metano. Tienen un importante papel en el ciclo del C, ya que transforman el metano procedente de la descomposición anaerobia en material celular y dióxido de carbono.
Estas bacterias son fáciles de identificar a la hora de hacer un cultivo porque forman estructuras rosadas por la presencia de carotenoides.
Pueden proceder de las nitrosoficantes, de Nitrosoccocus, que por mutación de la amoníaco monooxigenasa se transformara en MMO, porque las que tienen MMO también pueden usar como sustrato amoníaco y lo pueden oxidar en principio pero de ahí no obtienen energía y puede llegar a ser toxico si se acopla y no produce energía.
Bibliografía de imágenes
Mardanov, A. V., Gruzdev, E. V., Smolyakov, D. D., Rudenko, T. S., Beletsky, A. V., Gureeva, M. V., Markov, N. D., Berestovskaya, Y. Y., Pimenov, N. V., Ravin, N. V., & Grabovich, M. Y. (2020). Genomic and Metabolic Insights into Two Novel Thiothrix Species from Enhanced Biological Phosphorus Removal Systems. Microorganisms, 8(12), 2030. https://doi.org/10.3390/microorganisms8122030
Rudenko, T. S., Tarlachkov, S. V., Shatskiy, N. D., & Grabovich, M. Y. (2020). Comparative Genomics of Beggiatoa leptomitoformis Strains D-401 and D-402T with Contrasting Physiology but Extremely High Level of Genomic Identity. Microorganisms, 8(6), 928. https://doi.org/10.3390/microorganisms8060928
Zeytun, A., Sikorski, J., Nolan, M., Lapidus, A., Lucas, S., Han, J., Tice, H., Cheng, J. F., Tapia, R., Goodwin, L., Pitluck, S., Liolios, K., Ivanova, N., Mavromatis, K., Mikhailova, N., Ovchinnikova, G., Pati, A., Chen, A., Palaniappan, K., Ngatchou-Djao, O. D., … Kyrpides, N. C. (2011). Complete genome sequence of Hydrogenobacter thermophilus type strain (TK-6). Standards in genomic sciences, 4(2), 131–143. https://doi.org/10.4056/sigs.1463589
Zhang, Y., Zhang, S., Zhao, D., Ni, Y., Wang, W., & Yan, L. (2019). Complete Genome Sequence of Acidithiobacillus Ferrooxidans YNTRS-40, a Strain of the Ferrous Iron- and Sulfur-Oxidizing Acidophile. Microorganisms, 8(1), 2. https://doi.org/10.3390/microorganisms8010002
Zhang, Y., Zhang, Y., Gao, J., Shen, Q., Bai, Z., Zhuang, X., & Zhuang, G. (2018). Optimization of the medium for the growth of Nitrobacter winogradskyi by statistical method. Letters in applied microbiology, 67(3), 306–313. https://doi.org/10.1111/lam.13036
