- Microbiología
- Bacterias
- Eucariotas
- Virus
- Herramientas
- Blog
¿Alguna vez te has preguntado cómo las bacterias logran mantener su forma y protegerse a sí mismas contra factores externos? La respuesta está en el peptidoglicano, una molécula clave en la estructura de la pared celular de las bacterias.
Este material es tan importante para ellas, que sin él simplemente se desintegrarían. ¿Quieres saber más sobre cómo el peptidoglicano juega un papel crucial en la biología bacteriana? ¡Sigue leyendo para descubrirlo!
Índice de contenidos
El peptidoglicano es un compuesto exclusivo de bacterias, formado por azúcares y aminoácidos, de ahí su nombre (péptido, uno o más aminoácidos unidos mediante enlaces químicos; glicano, polímero de monosacáridos, o, en otras palabras, conjunto de azúcares simples). No es una proteína.
Es el compuesto cuya función es dar rigidez, consistencia y forma a la pared celular bacteriana. De hecho, si se inhibe su biosíntesis o su degradación especifica durante el crecimiento celular esto acaba provocando la lisis celular; de ahí que muchos antibióticos ataquen estos procesos.
La pared celular es un elemento de suma importancia en la bacteria, ya que resiste la gran presión osmótica interna de la célula, y el peptidoglicano es el elemento clave para sus características. La composición química de esta compuesto es bastante similar en GRAM+ y GRAM-, aunque tienen diferencias que veremos más adelante. De hecho, esas diferencias son las que dividen a las bacterias en estos dos grupos: bacterias gram positivas y gram negativas. El peptidoglicano también se conoce como peptidoglucano o mureína. Es un compuesto que aparece exclusivamente en bacterias; no aparece en organismos eucariotas.
La cubierta de peptidoglicano envuelve a la célula bacteriana, y se encuentra por encima de la membrana celular, pero debajo de la membrana externa en las bacterias que tengan esta estructura (bacterias GRAM negativas).
El peptidoglicano está formado por una secuencia alternante de dos azúcares, N-acetil-glucosamina (NAG) y el ácido N-acetilmurámico (NAM), unidos por enlaces β(1→4), entre el C1 de NAM y el C4 de NAG*. NAM es un derivado de NAG al que se le ha añadido una molécula de ácido láctico en el C3. La estructura del peptidoglicano está conformada por tres capas que veremos a continuación.
*En el caso de las arqueas, su pared celular tiene pseudopeptidoglucano formado por N-acetil-glucosamina unida a N-acetiltalosaminomurámico mediante enlaces β(1→3).
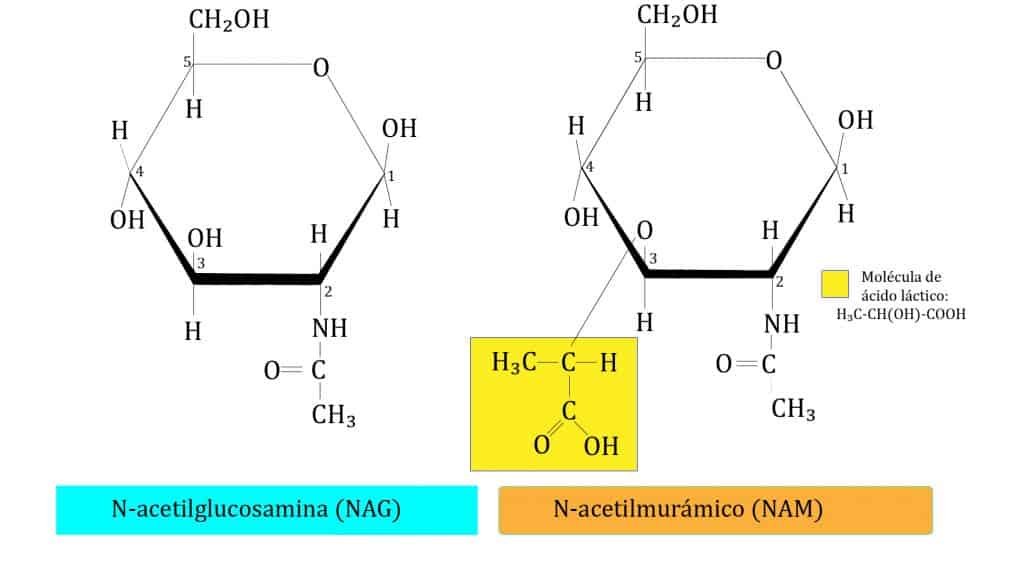
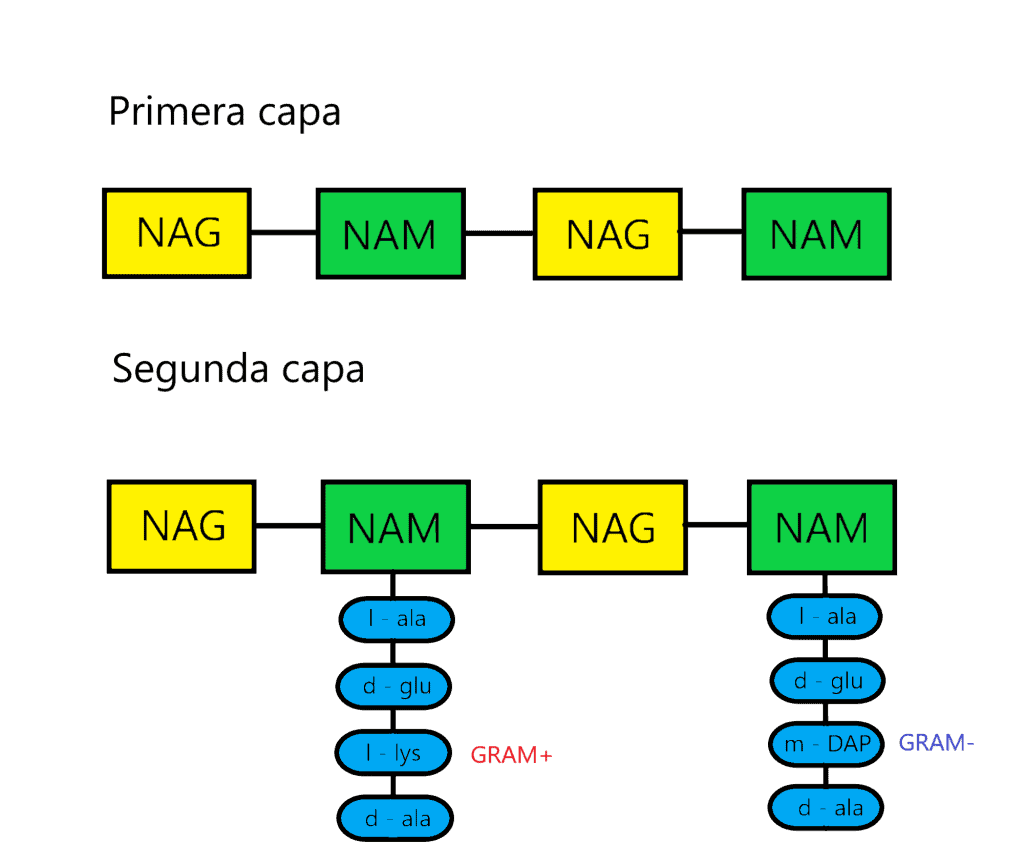
La primera capa del peptidoglicano (horizontal) está formada por filas lineales de NAG y NAM unidos de forma secuencial, mediante enlaces covalentes.
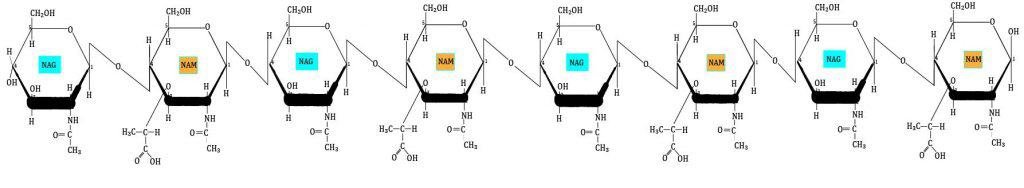
La segunda capa (vertical) está formada por un tetrapéptido unido solamente a NAM (esta es otra diferencia entre NAG y NAM). A este tetrapéptido se le denomina tetrapéptido del glicano. Este tetrapéptido contiene:
La formulación de estos aminoácidos unidos a NAM se encuentran en la imagen de abajo.
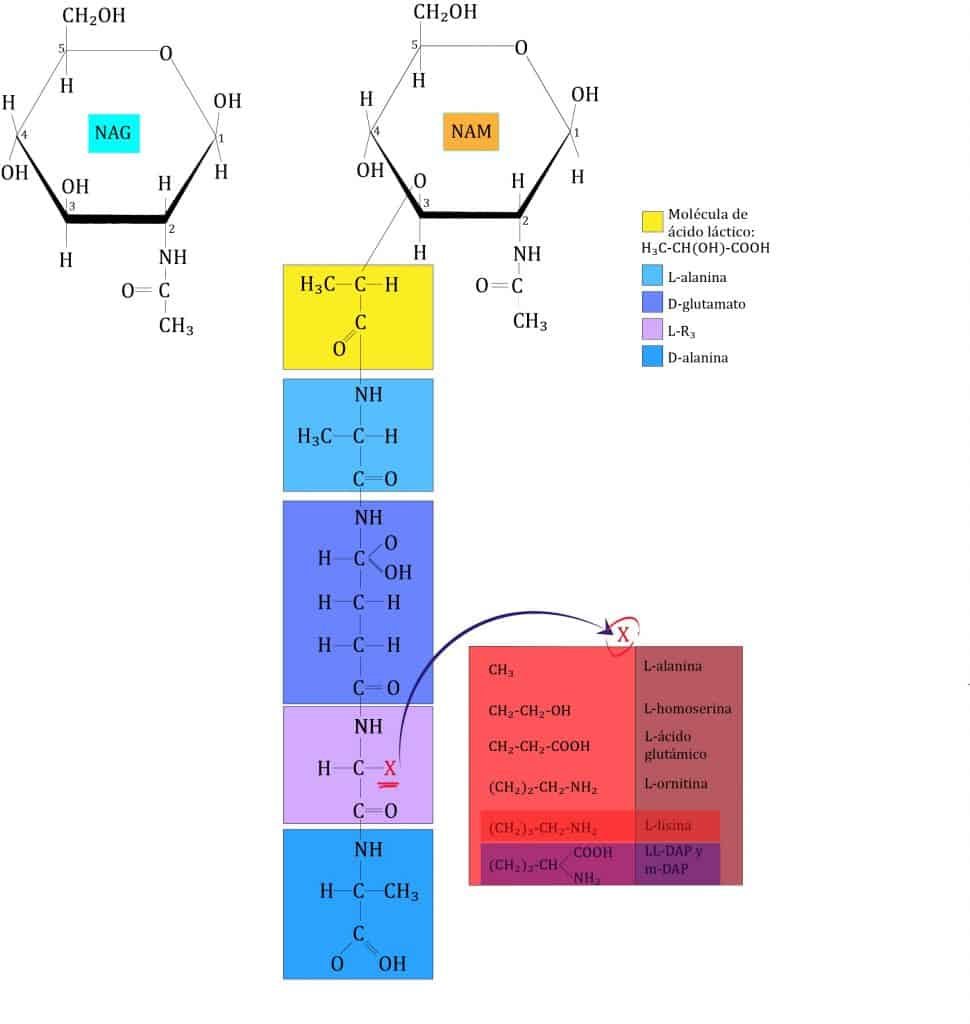
Como se puede ver, aquí aparecen proteínas formadas tanto de d-aminoácidos como de l-aminoácidos, de ahí una de sus particularidades (ya que las células usan solo l-aminoácidos para formar proteínas).
La tercera capa está formada por la unión de dos NAM vecinos. Para ello, la mayoria de veces se forma un enlace peptídico entre el cuarto aminoácido de un tetrapéptido (d-alanina) y el tercero de otro (L-lisina o m-DAP) mediante una reacción de transpeptidación. La composición de estos puentes peptídicos varía entre los diferentes grupos bacterianos; de hecho, los aminoácidos y la posición de este enlace se ha usado para clasificarlos (taxonomía). En bacterias GRAM- y algunas especies de Bacillus el enlace es directo, entre la D-alanina y el ácido diaminopimélico (m-DAP). En la mayoría de bacterias GRAM+ hay un puente formado por uno o más aminoácidos. Ejemplos:
A veces el puente es desde el aminoácido D-alanina terminal hasta el α-carboxilo de ácido D-glutámico del otro tetrapéptido. Debido a que hay una conexión entre 2 grupos carboxilo, es necesario que el puente contenga diaminoácidos.
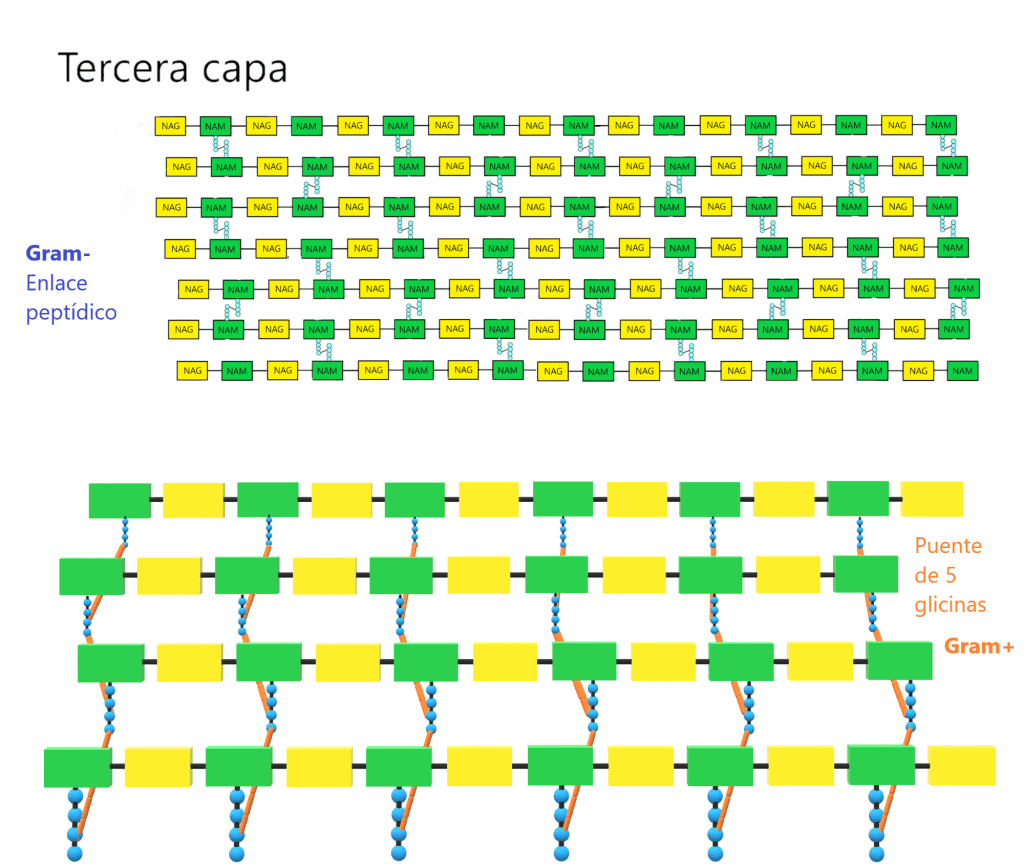
Estas tres capas forman la estructura tridimensional que da rigidez a la pared. Aunque pueden haber variaciones en la parte proteica del peptidoglicano, los enlaces entre NAG y NAM iguales para todas las especies bacterianas. No todos los tetrapéptidos unidos a NAM sufren la reacción de transpeptidación. De hecho, la pared tiene que tener algo de porosidad para permitir el paso de sustancias por la pared. Además, para que la célula pueda replicarse, necesita dividirse, expandirise, y es otra razón por la que la pared debe tener cierta flexibilidad. Ahora bien, cuantos más tetrapéptidos sufren la reacción de transpeptidación, más resistente será la pared celular.
La síntesis del nuevo peptidoglicano ocurre durante el proceso de crecimiento celular. Hay cuatro fases en este proceso. Primero, se forman los precursores del PG, que son derivados UDP de aminoazúcares formados en el citosol. Después, los aminoazúcares se transfieren a un transportador lipídico de membrana que los lleva a los aminoazúcares a través de la membrana celular. Más adelante, el PG se formará en la superficie externa de la membrana. Por último, ocurrirá la reacción de transpeptidación que forma puentes entre tetrapéptidos de NAM.
Los azúcares NAG y NAM son los precursores del PG. Ambos se forman a partir de la fructosa-6-fosfato. Las reacciones se pueden ver en la imagen de abajo. Todo empieza cuando la glutamina da un grupo amino a la fructosa-6-fosfato, que la convierte en glucosamina-6-fosfato (1) Esta reacción esta mediada por la enzima fructosa-6-fosfato aminotransferasa. Más tarde, una transacetilasa (glucosamina fosfato transacetilasa) transfiere un grupo acetilo que proviene del acetil-CoA al grupo amino de la glucosamina-6-fosfato, y forma la N-acetilglucosamina-6-fosfato (2). La N-acetilglucosamina-6-fosfato sufrirá un proceso de isomerización, mediada por la N-acetilglucosamina fosfomutasa que la transformará en N-acetilglucosamina-1-fosfato (3). Este monofosfato ataca a UTP, y desplaza el pirofosfato, cambiando el compuesto a UDP-N-acetilglucosamina (UDP-GlcNAc); reacción en la que interviene la enzima UDP-N-acetilglucosamina fosforilasa (4). A partir de aquí, algunos de los UDP-GlcNAc se usan como precursores de la N-acetilglucosamina, mientras que otros se convierten en ácido UDP-N-acetilmurámico (UDP-MurNAc).
UDP-GlcNAc se covierte en UDP-MurNAc añadiendo un grupo lactilo (5). Durante está reacción, mediada por la enolpiruvato transferasa, el grupo hidroxilo C₃ desplaza un fosfato del carbono α del fosfoenolpiruvato, formando el UDP-N-acetilglucosamina-3-enolpiruvatoéter. Después, el derivado de enol se reduce a una porción de lactilo mediante el NADPH, en una reacción llevada a cabo por la enzima UDP-N-acetilglucosamincenol-piruvato reductasa (6). UDP-MurNAc se acaba convirtiendo en pentapéptido UDP-MurNAc mediante la adición secuenciada de (7):
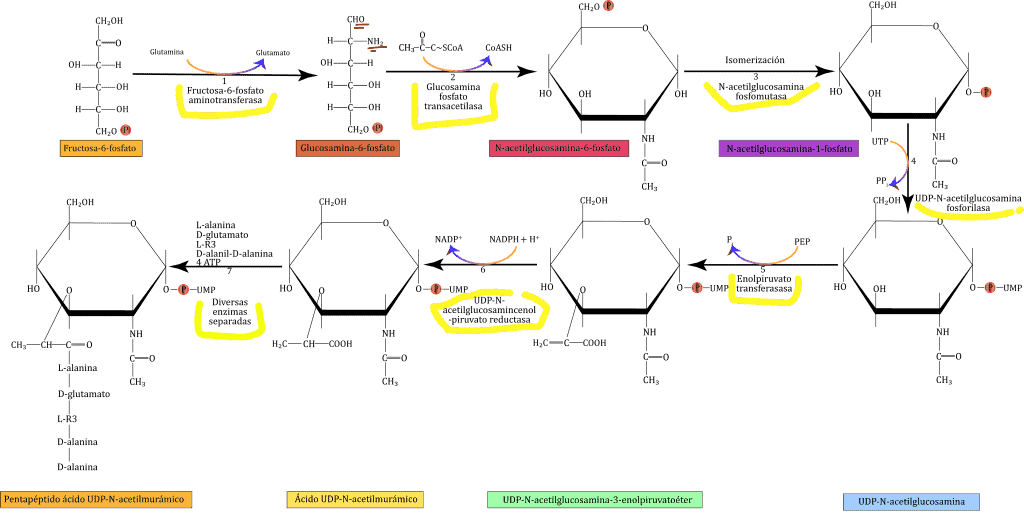
Cada reacción es catalizada por enzimas específicas y requiere ATP para activar el grupo carboxilo del aminoácido. El grupo carboxilo es un acil fosfato, que es atacado por el grupo amino que viene a unirse al aminoácido, desplazando el fosfato. Esta reacción produce ADP y un fosfato inorgánico. El dipéptido D-alanil-D-alanina se forma por la actuación de dos enzimas: la L-alanina-racemasa, que convierte L-alanina en D-alanina; y la D-alanil-D-alanil sintetasa dependiente de ATP, que forma D-alanil-D-alanina a partir de 2 D-alaninas. La quinta D-alanina se extraerá de esta estructura en el proceso de transpeptidación que veremos más adelante. Ambas enzimas, la racemasa y la sintetasa, son inhibidas por el antibiotico D-cicloserina.
Este pentapéptido UDP-MurNAc se transfiere al transportador lipídico en la membrana, y empiezan así los procesos en la membrana celular.
El transportador lipídico que al que nos referimos es el bactoprenol (o undecaprenil-fosfato), un isoprenoide fosfato C55 hidrófobo. Además de transportar los precursores del PG, también mueve los precursores de otros polímeros, como el lipopolisacárido (LPS) o los ácidos teicoicos. Los nucleótidos azucarados se mueven por difusión a la superficie citoplasmática de la membrana, y allí el bactoprenol (lípido-P) ataca al pentapéptido UDP-MurNAc, liberando UMP (1). El producto es el pentapéptido lípido-PP-MurNac. GlcNAc se transfiere del UDP-GlcNAc a MurNAc en el transportador lipídico cuando el C4 hidroxilo en MurNAc ataca el carbono C1 en UDP-GlcNAc, liberando UDP (2). El compuesto resultante es el disacárido precursor del PG, pentapéptido lipido-PP-MurNAc-GlcNAc. Este compuesto se moverá al otro lado de la membrana (3). Si bien no se sabe exactamente como se mueve a través de la membrana, parece ser que es ayudado por proteínas aun por identificar.
Las proteínas fijadoras de penicilina (PBP), o autolisinas, estarán envueltas en los procesos de transglicosilación, transpeptidación y carboxipeptidación. En el lado externo de la membrana, este compuesto es transferido al glicano en formación y se sitúa en la parte final de la cadena. Esta reacción es una transglicosilación en la cual el C4 hidroxilo de GlcNAc en formación ataca el C1 de MurNAc del glicano, desplazando el bactoprenol de la cadena de glicano que se está formando (4,5). Esta reacción es catalizada por una enzima transglicosilasa ligada a la membrana (PBP-1a y PBP-1b).
No obstante, la cadena de glicano en formación sigue anclada a la membrana por el carrier lipídico en el sitio de la transglicosilasa. El lípido-PP formado por la cadena en formación se hidroliza por una pirofosfatasa ligada a la membrana, que forma lípido-P y libera un fosfato (6). Esta reacción es de suma importancia, ya que finaliza la reacción de transglicosilación, debido a que la hidrólisis del fosfodiester libera energía (el fosfato). Además, así se vuelve a formar el lípido-P (bactoprenol) que se puede reutilizar para la formación de PG u otros polímeros (7). Esta hidrólisis es inhibida por el antibiótico bacitracina.

El proceso de síntesis de peptidoglicano debe estar perfectamente coordinado. Los nuevos tetrapéptidos se deben unir al PG existente justo después de que las autolisinas actúen. Sino, se formaría una brecha en la integridad del PG en el punto de empalme, que podría desembocar en la lisis espontánea de la bacteria (autolisis).
Para formar los puentes peptídicos entre los tetrapéptidos de NAM de cadenas adyacentes y así unir a los péptidos (cross-linking) hace falta energía. La transpeptidación es el proceso por el cual se obtiene energía necesaria para unir a los péptidos. En el peptidoglicano maduro, un grupo NH₂ del diaminoácido de la tercera posición (por ejemplo, el diamino-pimélico) ataca el carbonilo (C=O), desplazando el aminoácido D-alanina terminal (hidrolización). Este proceso está mediado por transpeptidasas (PBP-1a y PBP-1b). Los residuos D-alanina terminales que no participan en estas uniones también se eliminan, pero este proceso lo lleva a cabo la carboxipeptidasa D-alanina (PBP-4, PBP-5 y PBP-6). Diversos antibióticos, como la penicilina, inhiben esta reacción.
Como ya hemos comentado, la pared celular tiene muchas funciones, y una de ellas es resistir la presión osmótica interna de la bacteria. El peptidoglicano es de suma importancia para que la pared celular tenga las propiedades que necesita la bacteria. De hecho, si se inhibe la biosíntesis del peptidoglicano o su degradación especifica durante el crecimiento celular esto acabará desembocando en la lisis de la célula (destrucción de la célula). Por ese motivo, usamos diversos antibióticos que atacan dichos procesos. Veamos varios antibióticos que se usan para el tratamiento antimicrobiano:
El peptidoglicano, si bien es un compuesto común de las bacterias, tiene diferencias entre organismos GRAM+ y GRAM-, como los que veremos a continuación (en la tabla final se puede ver un resumen de estas).
En bacterias GRAM+, el peptidoglicano ocupa hasta el 90% de la pared celular. Pueden aparecer bacterias con solo una capa de peptidoglicano rodeando a la célula, pero la mayoría de bacterias cuenta con muchas láminas apiladas unas sobre otras. Eso sí, la capa se sitúa en el exterior de la membrana plasmática. En la tinción de Gram, dentro de las células se forma un complejo cristal violeta-yodo que NO puede extraerse. Y es debido a sus gruesa pared celular formada por varias capas de peptidoglicano. Al introducir alcohol, se deshidratan, lo que provoca el cierre de los poros de las paredes, así que el colorante no sale de la bacteria. Además, en bacterias GRAM+ aparecen los llamados ácidos teicoicos. Son polímeros de la pared que contienen unidades de glicerolfosfato o de ribitolfosfato. También pueden tener unidos otros azúcares y d-alanina. Los ácidos teicoicos se unen mediante enlace covalente a residuos de NAM. Pueden intervenir uniendo calcio (Ca2+) y magnesio (Mg2+) para su transporte. Tienen carga negativa, así que tienen su parte de responsabilidad de la carga negativa de la superficie celular.
En bacterias GRAM-, el peptidoglicano ocupa hasta el 10% de la pared celular. Está situada entre la membrana externa y la membrana interna de la célula. La mayor parte de la pared celular está formada por la membrana externa, una segunda bicapa lipídica que, aparte de fosfolípidos y proteínas, también contiene polisacáridos. A esta membrana se le llama lipopolisacárido (LPS). En la tinción de Gram, dentro de las células se forma un complejo cristal violeta-yodo que puede extraerse. Y es debido a que la membrana externa es rica en lípidos, además de que la capa de peptidoglicano es tan fina que no impide el paso del solvente, así que el colorante sale de la célula. Después del tratamiento con alcohol, estas bacterias reciben una tinción de contraste, la safranina, para diferenciarse de las bacterias GRAM+.
| Diferencias entre bacterias GRAM+ y GRAM- | ||
|---|---|---|
| Bacterias | GRAM+ | GRAM- |
| Tamaño de PG | Hasta 90% de la pared celular | Hasta el 10% de la pared celular |
| Localización del PG | Al exterior de la membrana plasmática | Entre la mebrana interna y la membrana externa |
| Tinción de GRAM | Complejo cristal violeta-yodo | Safranina |
| Color en la tinción de GRAM | Azul, violeta | Rojo, rosa, naranja |
| Tercer aminoácido del tetrapéptido | L-lisina normalmente; mucha variación de aminoácidos | m-DAP casi siempre; poca variación de aminoácidos |
| Transpeptidación (cross-linking) | Casi siempre puente de aminoácidos | Casi siempre enlace directo |
| Compuestos unidos a PG | Ácidos teicoicos | Lipopolisacárido (LPS) |
El pseudopeptidoglicano, también conocido como pseudomureína, es uno de los principales componentes de la pared celular de ciertas arqueas metanogénicas. Aunque su estructura química es diferente a la del peptidoglicano de las bacterias, ambos cumplen funciones similares en la protección y rigidez de la célula.
A nivel estructural, el pseudopeptidoglicano está compuesto por dos azúcares: N-acetilglucosamina (NAG) y ácido N-acetiltalosaminurónico (NAT). Esta diferencia clave con el peptidoglicano bacteriano, que contiene ácido N-acetilmurámico (NAM) en lugar de NAT, se refleja también en los enlaces que forman la cadena. En el pseudopeptidoglicano, los azúcares están unidos por enlaces β-1,3-glicosídicos, a diferencia de los β-1,4-glicosídicos presentes en el peptidoglicano.
Esta estructura única hace que el pseudopeptidoglicano sea resistente a la lisozima, una enzima presente en las secreciones humanas como saliva y lágrimas, que descompone el peptidoglicano bacteriano al romper los enlaces β-1,4. Al no poder actuar sobre los enlaces β-1,3 del pseudopeptidoglicano, la lisozima se vuelve ineficaz frente a las arqueas que poseen este polímero en sus paredes celulares.
Existen varias diferencias importantes entre el peptidoglicano bacteriano y el pseudopeptidoglicano de las arqueas:
Al igual que el peptidoglicano en las bacterias, el pseudopeptidoglicano en las arqueas tiene la función de proporcionar rigidez estructural y protección frente a condiciones externas adversas. Actúa como una barrera, ayudando a las células a mantener su forma y protegiéndolas de factores ambientales perjudiciales.
Además, debido a su composición única, es resistente a ciertos antibióticos que atacan la pared celular bacteriana, como la penicilina, que resulta ineficaz contra el pseudopeptidoglicano debido a las diferencias en las enzimas implicadas en la reticulación de los aminoazúcares.
El pseudopeptidoglicano ofrece una ventana a las estrategias evolutivas de las arqueas frente a las bacterias. Su resistencia a enzimas bacterianas, como la lisozima, y su insensibilidad a ciertos antibióticos demuestran cómo las arqueas han desarrollado adaptaciones únicas para sobrevivir en ambientes extremos.
Estas características podrían haber sido moldeadas por las presiones evolutivas en entornos inhóspitos, como los océanos profundos o los hábitats metanogénicos, donde las arqueas prosperan.
Calvo. J, Martínez-Martínez. L, Mecanismos de acción de los antimicrobianos. (2009) Enfermedades Infecciosas y Microbiología Clínica, Volume 27, Issue 1, Pages 44-52, ISSN 0213-005X. DOI: 10.1016/j.eimc.2008.11.001.
Mensa. J, Gatel. J. M, García-Sanchez. J. E, Letang. E, López-Suñe. E, Marco. F. (2018) Guia de terapeútica antimicrobiana 2018, Editorial: Antares, Nº de edición: 28ª, ISBN-13: 9788488825247
Mechthild Pohlschroder, Friedhelm Pfeiffer, Stefan Schulze, Mohd Farid Abdul Halim, Archaeal cell surface biogenesis, FEMS Microbiology Reviews, Volume 42, Issue 5, September 2018, Pages 694–717, https://doi.org/10.1093/femsre/fuy027
Michael T. Madigan. (2015) Brock: biología de los microorganismos. Edición 14. Pearson Educación. ISBN: 8490352798, 9788490352793
Vollmer, W., & Höltje, J. V. (2000). A simple screen for murein transglycosylase inhibitors. Antimicrobial agents and chemotherapy, 44(5), 1181–1185. https://doi.org/10.1128/aac.44.5.1181-1185.2000
Vollmer W, Blanot D, de Pedro MA. (2008) Peptidoglycan structure and architecture. FEMS Microbiol Rev. 2008;32(2):149‐167. doi:10.1111/j.1574-6976.2007.00094.x
White, D., Drummond, J., & Fuqua, C. (2012). The physiology and biochemistry of prokaryotes. New York: Oxford University Press.