- Microbiología
- Bacterias
- Eucariotas
- Virus
- Herramientas
- Blog
Los bacteriófagos, o fagos, son virus que infectan a bacterias. Esta característica les hace interesantes para un uso terapeútico. Con el problema de las bacterias resistentes a los antibióticos, se están buscando alternativas que sustituyan, o complementen, a la terapia antimicrobiana clásica.
En este artículo veremos todo lo que debes conocer sobre los bacteriófagos, así como los posibles usos que pueden tener en el ámbito de la medicina ¡Comenzamos!
Índice de contenidos
Los bacteriófagos (o simplemente "fagos") son virus que infectan a bacterias. Son parásitos bacterianos obligatorios, lo que significa que no se pueden reproducir de manera independiente, así que necesitan a una bacteria huésped para su supervivencia.
En esencia, son entidades biológicas no vivientes que consisten en ADN o ARN incrustado dentro una cápside proteica. Son parásitos bacterianos obligatorios, lo que significa que no se pueden reproducir de manera independiente, así que necesitan a una bacteria huésped para su supervivencia (Lin et al., 2017).
A pesar de ser tan sencillos, son muy diversos, y tienen varios criterios de clasificación (Lin et al., 2017; Wittebole et al., 2014). Los fagos muestran 4 ciclos diferentes que pueden usar para infectar la bacteria hospedadora: lítico, lisogénico, pseudo-lisogénico e infección crónica. (Wittebole et al., 2014).
La descripción general de estos fagos es la siguiente: el material genético está contenido dentro de una cubierta proteica o cápside; esta cápside está conectada a la cola a través del collar. Esta cola, en su extremo más distal, está en contacto con fibras de la cola con espículas que reconocen lugares de acoplamiento en los receptores de la superficie bacteriana celular (Wittebole et al., 2014).
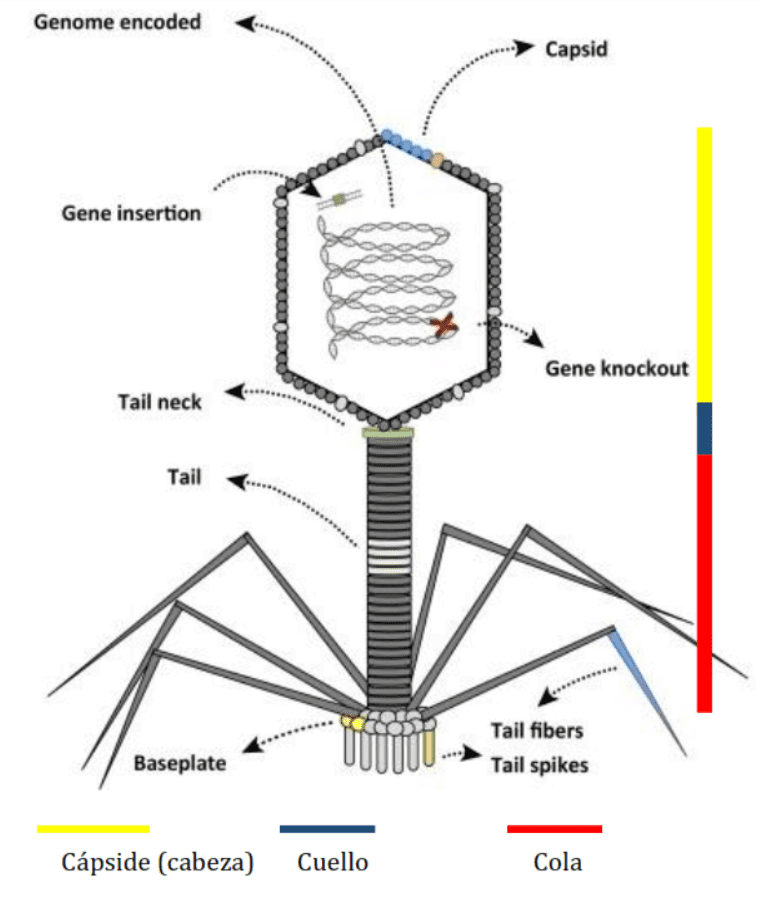
Podemos observar procesos determinados que son comunes para todos los virus. Éstos son:
El primer paso es el acoplamiento a los receptores de la pared celular bacteriana para que el fago pueda entrar a la bacteria (adsorción). La mayoría de fagos se adsorben sobre la pared celular bacteriana. No obstante, también hay algunos que lo hacen sobre el flagelo o los pili sexuales.
Podríamos dividir este procedimiento en dos subprocesos; el primero, tras el contacto inicial del fago con la superficie bacteriana externa, es reversible, y ofrece la posibilidad al fago de “decidir” en vez de infectar. En el segundo subproceso, el fago se une manera irreversible a la bacteria (Weinbauer, 2004).
Este proceso es de gran importancia, ya que influye de manera determinante en las posibles interacciones fago-bacteria. Algunos fagos pueden sintetizar enzimas específicas, tales como hidrolasas, polisacaridasas y polisacárido liasas, con capacidad de degradar cápsulas con exopolisacáridos, antes de interactuar con su receptor específico. (Wittebole et al., 2014). Estas enzimas podrían tener un espacio en el ámbito terapéutico, como veremos más adelante.
Tras unirse a su receptor específico, los fagos forman un poro en la pared celular e inyectan su material genético en la célula, mientras la cápside viral permanece en el exterior de la célula (penetración) (Wittebole et al., 2014). Ahora bien, hay algunas excepciones en las que no solo entra el ácido nucleico e incluso puede entrar todo el virus.

Este proceso es común a todos los virus, con independencia del ciclo que tengan (Wittebole et al., 2014). A partir de aquí, cada ciclo tiene unos procesos diferentes, como veremos a continuación.
En el ciclo lítico, a esta acción le sigue la activación de genes fágicos de expresión rápida, que redirigen el metabolismo celular hacia la reproducción de material genético y proteínas virales. Antes de la lisis celular y la liberación de la progenie fágica, podemos observar un proceso de empaquetado de los fagos.
Diversas enzimas tardías de los fagos, como las lisinas, holinas, e inhibidores de la síntesis de mureína, se emplean para la liberación de los viriones hacia el entorno extracelular, que ocurre tras la lisis de la bacteria huésped. El número de partículas virales liberadas al exterior puede variar, y depende del estado de la bacteria huésped, de diversos factores ambientales y del propio fago (Maciejewska et al., 2018; Weinbauer, 2004; Wittebole et al., 2014).
Ahora bien, la relación bacteria-fago es un continuo ciclo de coevolución; las bacterias han desarrollado mecanismos para resistir la infección de los fagos. Para evitar el acoplamiento del fago están la alteración o perdida de los receptores, y la producción de polímeros extracelulares o de moléculas que compitan por los receptores a los que se une el fago.
Para evitar la entrada del ADN existen los sistemas de exclusión de infecciones Sie, y para la modificación de los ácidos nucleicos del fago aparecen los sistema de restricción-modificación (R-M) y el sistema CRISPR-Cas (Labrie et al., 2010). Pero los fagos también desarrollan procesos para evitarlos; así, aparecen el reconocimiento de los receptores alterados o nuevos, o los genes anti-CRISPR (Lin et al., 2017).
En el ciclo lisogénico, los bacteriófagos integran su contenido genético en los cromosomas de la bacteria, en forma de profago[1] endógeno, y éste permanece dentro del ADN de la bacteria silenciado por largos periodos de tiempo. Más tarde, podrá ser replicado como parte del cromosoma bacteriano; de manera que, en este caso no hay autorreplicación.
Por consiguiente, el profago se transmite con cada división celular (Lin et al., 2017; Wittebole et al., 2014). Los factores ambientales pueden estresar a la bacteria, e inducir la evolución del fago hacia un ciclo lítico, donde éste libere su descendencia al exterior (proceso de inducción) (Lin et al., 2017; Weinbauer, 2004).
Durante la fase lisogénica, el material genético de los bacteriófagos puede ser transferido del cromosoma de una bacteria a otra bacteria; este proceso es denominado transducción. Esta transferencia puede desembocar en la aparición de factores de virulencia y desencadenar toxinas no deseadas, o factores de resistencia, lo que provoca que los fagos lisogénicos no sean aptos para la terapia fágica convencional (Brunel and Guery, 2017; Nilsson, 2014; Wittebole et al., 2014).
Sin embargo, este proceso también puede ser utilizado de manera terapéutica usando a los fagos para la transferencia de genes, de forma que provoquen que las bacterias sean más sensibles a determinados antibióticos (Wittebole et al., 2014).
1 Genoma de un fago que se ha perpetuado en la bacteria hospedadora al integrarse en su cromosoma.
El fago lambda presente morfología tipo B, y tiene un genoma de ADN de doble cadena de 48.5kbp. Tiene los llamados extremos cos, secuencias repetitivas en los extremos de su genoma y que son complementarias entre sí. Cuando el genoma entra en el hospedador, se convierte en forma circular y se cierra mediante la actividad de una ADN ligasa bacteriana.
Este bacteriófago solo infecta a la bacteria Escherichia coli, y en unas condiciones específicas. En su caso, la bacteria tiene que expresar un transportador de maltosa (lamB) en presencia de iones Mg2+. Si hay presencia de maltosa en el medio se induce la presencia del transportador de maltosa y el fago se puede unir a él.
En condiciones normales, el fago lleva a cabo un ciclo lítico. La lisogenia se establece según el estado metabólico de la bacteria que está siendo infectada: si está en condiciones óptimas de crecimiento, habrá ciclo lítico; si las condiciones no son buenas, se producirá lisogenia.
En una primera fase el dsDNA circular del bacteriófago se replica según un modelo bidireccional, para finalmente hacerlo mediante un mecanismo de círculo rodante. Sin embargo, si al final lo que se produce es el ciclo lisogénico, se producirá su recombinación e integración en el cromosoma bacteriano de manera específica, en el sitio att.
La integración es llevada a cabo por int, una integrasa producida por el virus, junto a ciertas proteínas bacterianas (IHF). Int es la enzima que modula la integración. Habrá una recombinación específica entre el sitio att del fago (attP) y el de E. coli (attB). El resultado de la integración es una permutación en el genoma bacteriano del fago lambda, quedando así el lambda en forma de profago.
Es el proceso por el que un bacteriófago pasa de un estado lisogénico al estado lítico. Usemos como ejemplo a la bacteria E. coli lisogenizada por el fago lambda. El estado lisogénico se mantiene por medio de un represor, la proteína C1, cifrada por el propio fago. Su misión es regular la estabilidad de la fase de lisogenia y no permitir que el genoma viral salga del genoma bacteriano ni que se exprese.
Ahora bien, hay diversas situaciones de estrés (en especial, la luz ultravioleta) que provocan una inducción de la proteína bacteriana RecA. Esta proteasa (inducida en caso de daño al ADN) tiene gran afinidad por C1, así que esta se degrada, lo que provoca la escisión del fago lambda como profago y la recuperación del genoma circularizado. Una vez el genoma vírico sale del genoma bacteriano, se establece el ciclo lítico.
El ciclo pseudolisogénico ocurre cuando el ADN viral aparece en forma de plásmido en la bacteria huésped, de forma independiente, sin formar parte del ADN de la bacteria. El desarrollo de la progenie se paraliza, y no hay una multiplicación del genoma fágico. Este ciclo normalmente es causado por la aparición de condiciones desfavorables para la replicación del fago, así que, cuando las condiciones ambientales mejoran, en el fago se inicia el ciclo lisogénico real, o el lítico.
En el ciclo de infección crónica el fago lisogénico ha mutado, de forma que el material genético del fago forma parte del cromosoma bacteriano, y se convierte en un profago de larga duración. La bacteria es infectada, pero ocurre de tal forma, que se libera la progenie del fago de manera continuada sin lisar dicha bacteria.
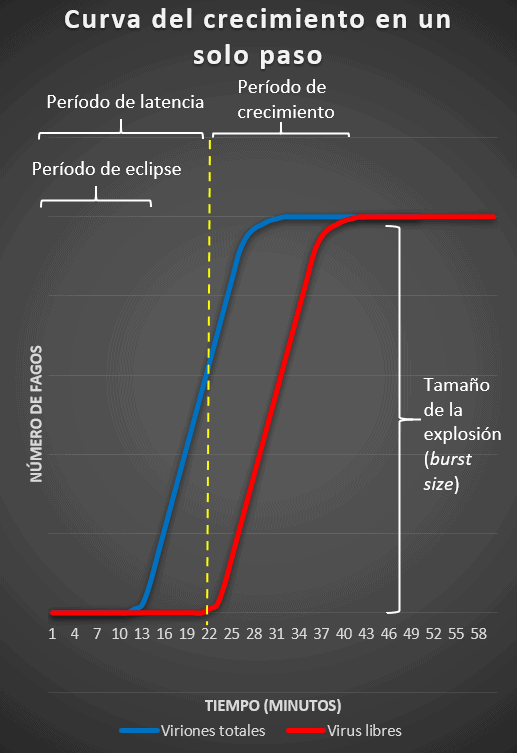
El "experimento de crecimiento en un solo paso" fue diseñado por Ellis y Delbruck en 1939. Con él, pretendían estudiar el crecimiento de los virus. Para ello eligieron a los bacteriófagos, ya que las bacterias son hospedadores con una complejidad bastante menor a la de animales y plantas, por ejemplo. Este experimento analiza la interacción bacteriófago-bacteria desde un punto de vista cuantitativo, y supone el comienzo de la investigación bacteriofágica moderna.
Para el experimento se usaron diversas bacterias susceptibles a la infección de los fagos; entre ellas, E. coli. Se mezclaban a dichas bacterias con partículas fágicas, y a los fagos se les permitía atacar a su hospedador durante un corto intervalo de tiempo. Si los fagos se replican en las bacterias, aparecerán fagos en el medio de cultivo. Además, también aparecerán bacterias infectadas que aun no se han lisado.
Después, el cultivo infectado se diluye, de forma que los viriones expulsados al exterior no podrían infectar nuevas bacterias. El bacteriófago necesita contacto físico con la bacteria para unirse a ella, y esto se previene mediante el alto grado de dilución, que hace que sea improbable el contacto del fago con un hospedador.
El número de bacteriófagos infectivos está determinado durante ciertos intervalos que se pueden ver bien en una gráfica. Estas son las fases que aparecen:
El número total de los bacteriófagos liberados se puede usar para calcular el tamaño de la explosión (burst size): el número de virus producidos por célula infectada.
Dentro de los virus bacterianos, la mayoria son fagos con genoma de ADN, siendo los más abundantes los de doble cadena. Los fagos más destacados son:
Como se ha podido ver, estos virus (fagos, virus que matan bacterias) son de especial interés en el mundo de la medicina, ya que uno de los grandes problemas que tenemos en la actualidad es el de la aparición de bacterias resistentes a los antibióticos y la terapia con bacteriófagos ha mostrado ser una posible alternativa.
De hecho, en la época previa a los antibióticos la fagoterapia era conocida y se usaba comúnmente. Pero el auge de los antibióticos (y algunas razones más) provocaron que este tratamiento quedara relegado en el ostracismo; no obstante, ha vuelto a surgir un renovado interés por las posibles aplicaciones que pueden tener los bacteriófagos en terapia antimicrobiana.
El descubrimiento de los antibióticos ha revolucionado la asistencia médica y ha mejorado, tanto la cantidad como la calidad de vida humana (Lin et al., 2017). Durante su época más dorada, muchas vidas han sido salvadas (Golkar et al., 2014). De esta manera, los antibióticos se convirtieron en la principal defensa frente a las infecciones bacterianas en la medicina de Occidente (Keen, 2012).
Por ejemplo, en 2011, solo en Estados Unidos fueron prescritos unos 262.5 millones de tratamientos con antibióticos, sin contar los millones de toneladas de antibióticos usados a nivel mundial en el campo de la medicina, la agricultura y la horticultura cada año (Lin et al., 2017).
No obstante, las bacterias son seres vivos con una gran capacidad de resiliencia, y han desarrollado diversas formas de resistencia hacia muchos de los antibióticos que usamos en nuestro día a día (Roach and Donovan, 2015). Pero este acontecimiento no debería habernos tomado por sorpresa.
De hecho, el mismo Alexander Fleming ya pronosticó hace unos 70 años que las bacterias adquirirían resistencia hacia los antibióticos (Skurnik et al., 2007). Pero, si bien la evolución hacia formas de resistencia ocurre de manera natural, tanto el exceso del uso, como el uso incorrecto de los antibióticos, ha contribuido a este desastroso aumento de formas bacterianas resistentes a los antibióticos (Golkar et al., 2014; Roach and Donovan, 2015).
La eficacia de los antibióticos ha disminuido a lo largo del tiempo, y es especialmente preocupante en las infecciones causadas por las bacterias del llamado grupo ESKAPE (Lin et al., 2017; Maciejewska et al., 2018). En la siguiente tabla podemos observar las bacterias que componen dicho grupo y los antibióticos principales que se usan para su tratamiento.
| Bacterias del grupo ESKAPE | Antibiótico(s) principal(es) para su tratamiento |
| Enterococcus faecium | Daptomicina |
| Staphylococcus aureus | Cloxacilina |
| Klebsiella pneumoniae | Cefalosporinas de 3ª generación (cefotaxima o ceftriaxona) |
| Acinetobacter baumannii | Imipenem asociado a sulbactam o a amikacina |
| Pseudomonas aeruginosa | Cefalosporinas de 3ª generación o carbapenems |
| Enterobacter spp. | Cefalosporina de 3ª generación o carbapenems |
Hacen falta nuevas clases de antimicrobianos para poder tratar a estos novedosos patógenos pero el desarrollo de nuevos antibióticos es prácticamente nulo (Lu and Koeris, 2011; Pirnay et al., 2012). Y aunque haya antibióticos disponibles en funcionamiento, estos antibióticos de amplio espectro, tales como el carbapenem, pueden tener efectos perjudiciales y prolongados en la microbiota beneficiosa de nuestro cuerpo (Keen, 2012), y por ello, son reservados como la última opción (Lin et al., 2017).
Las compañías farmacéuticas encuentran una gran dificultad para continuar desarrollando nuevos antibióticos; no son tan rentables como otros medicamentos, y, además, los pocos antibióticos que salen al mercado, no se usan inmediatamente; por el contrario, los médicos los reservan solo para los peores casos (Golkar et al., 2014).
Esta escasez de nuevos antibióticos se puede demostrar mediante un ejemplo: la FDA ha aprobado 6 nuevos antibióticos entre 2010 y 2016 para su uso en Estados Unidos (Lin et al., 2017). Así, el número de antibióticos se ha estancado, pero las formas de resistencia continúan aumentando (Brunel and Guery, 2017).
Debido a estas razones, tanto investigadores como organismos gubernamentales hablan de las bacterias resistentes a antibióticos como una amenaza presente a la salud mundial (Brüssow, 2012; Golkar et al., 2014; Górski et al., 2016; Keen, 2012; Kutateladze and Adamia, 2010; Lin et al., 2017; Lu and Koeris, 2011; Wittebole et al., 2014), que puede comprometer nuestro futuro (Brunel and Guery, 2017; Lin et al., 2017).
Por ello, hay un temor real a volver a entrar a una era anterior a la de los antibióticos (Lin et al., 2017; Pirnay et al., 2012; Sulakvelidze et al., 2001). El resultado de este fenómeno es un renovado interés en tratamientos antimicrobianos alternativos (Lu and Koeris, 2011).
La halicina es una forma alternativa de luchar contra este problema. Pero también aparece otra opción. Irónicamente, dicha opción a examinar es un tratamiento ya conocido antes del auge los antibióticos: la terapia con bacteriófagos, también denominada terapia fágica, terapia bacteriofágica o fagoterapia.
La fagoterapia tiene un renovado interés, y es considerada como un tratamiento “nuevo” (ya se conocía hace un siglo, de ahí las comillas) y con potencial de enfrentar a las amenazas de las bacterias patógenas (Adhya et al., 2014; Górski et al., 2016; Keen, 2012; Sulakvelidze et al., 2001; Wittebole et al., 2014).
Pero, para empezar, ¿qué son los bacteriófagos? “Los bacteriófagos son virus naturales de bacterias, que abundan en todos los ambientes, incluyendo tierra, agua y aire” (Kutateladze and Adamia, 2010). El descubrimiento de éstos se atribuye generalmente a Twort y d’Herelle, de manera independiente, a principios del siglo XX (Lu and Koeris, 2011), a saber, en 1915 y 1917, respectivamente (Nobrega et al., 2015).
De hecho, ya en ese pasado anterior a los antibióticos, los fagos fueron usados como agentes antimicrobianos contra diversas infecciones bacterianas (Roach and Donovan, 2015; Wittebole et al., 2014), pero tanto la falta de conocimiento acerca de la biología de los fagos, como la aparición de los antibióticos en los años cuarenta, dejaron a la terapia fágica relegada a un último plano en la medicina de Occidente, a saber, Estados Unidos y Europa Occidental (Adhya et al., 2014; Kutateladze and Adamia, 2010; Nobrega et al., 2015).
No así en la antigua Unión Soviética y Europa del Este, donde han seguido teniendo un uso clínico durante el mismo tiempo en el que en Occidente ha tenido a los antibióticos como su principal defensa frente a las infecciones (Abedon et al., 2017; Kutateladze and Adamia, 2010; Reindel and Fiore, 2017; Sulakvelidze et al., 2001; Wittebole et al., 2014).
Debido a este hecho, la escasez de ensayos clínicos escritos en inglés ha sido uno de los obstáculos a sobrepasar por la terapia fágica: la gran mayoría de ensayos aparecen en idiomas del Este de Europa, y no son fáciles de entender para la comunidad científica de Occidente. (Reindel and Fiore, 2017; Sulakvelidze et al., 2001).
No obstante, los bacteriófagos muestran características que han llamado la atención de la comunidad científica, e incitan a su investigación, siendo el más destacado la especificidad con la atacan a las bacterias (Kutateladze and Adamia, 2010; Wittebole et al., 2014).
De esta manera, pueden dañar a las bacterias objetivo a nivel de género o incluso especie (Roach and Donovan, 2015). Una consecuencia de esta especificidad es que los fagos no afectan a la microflora que aparece en el cuerpo de manera normal (Adhya et al., 2014; Kutateladze and Adamia, 2010; Nilsson, 2014).
Esta particularidad, junto a otras ventajas y usos que analizaremos en otros artículos, y la necesidad de encontrar alternativas a los antibióticos, es lo que ha provocado este renovado interés por parte de Occidente, tanto de investigadores, como de organismos gubernamentales, hacia este recuperado tratamiento (Abedon et al., 2017; Adhya et al., 2014; Nobrega et al., 2015; Reindel and Fiore, 2017).
Además, nuevas investigaciones han encontrado diversos usos de los bacteriófagos dentro de la terapia antimicrobiana. De esta manera, aparecen las enzimas codificadas por los fagos y la terapia combinada de fagos y antibióticos (Brunel and Guery, 2017), junto al uso de fagos en la vacunación (Adhya et al., 2014).
Para poder determinar si los bacteriófagos pueden ser considerados como una alternativa seria a la antibioterapia, la investigación sobre el uso de los virus de las bacterias debe ser ampliada para poder responder con seguridad a la pregunta: ¿pueden ser considerados los bacteriófagos una alternativa real a los antibióticos?
Como hemos visto, los fagos tienen diferentes ciclos de infección; no obstante, no todos los ciclos son relevantes para la terapia antimicrobiana.
Los fagos líticos son los más útiles dentro del campo de la terapia fágica convencional, siendo los más interesantes los que se encuentran dentro de 3 familias del orden Caudovirales; éstas son: Myoviridae, Siphoviridae y Podoviridae.
Los fagos lisogénicos, como ya hemos visto, pueden sufrir un proceso de transferencia del cromosoma de una bacteria a otra, lo que puede provocar que aparezcan factores de virulencia o toxinas no deseadas, razón por la que no se pueden usar en terapia fágica convencional.
Ahora bien, se podrían usar para transferir genes a una bacteria, haciendo que sea más sensible frente a otros tratamientos.
El descubrimiento de los bacteriófagos ha sido un gran tema de debate, y todavía hay controversia acerca de quién realmente describió por primera vez la actuación de los fagos (Abedon, Thomas-Abedon, et al., 2011; Sulakvelidze et al., 2001).
En 1896, Ernest Hankin (Hankin, 1896), bacteriólogo británico, informó en los Anales del Instituto Pasteur acerca de actividad antibacteriana frente a Vibrio cholerae en los ríos Ganges y Yamuna en India, y propuso que una sustancia, o principio biológico desconocido, capaz de pasar a través de filtros que sí retienen microorganismos como bacterias, como responsable de este fenómeno de limitar la difusión del cólera (Golkar et al., 2014; Sulakvelidze et al., 2001; Wittebole et al., 2014).
En 1898, Gamaleya (Gamaleya, 1898), bacteriólogo ruso, también observó un comportamiento similar al trabajar con Bacillus subtilis (Golkar et al., 2014; Sulakvelidze et al., 2001). De hecho, durante los siguientes 20 años podemos encontrar diversos trabajos en los que sus autores reportan sucesos similares a los ocurridos en los estudios de Hankin y Gamaleya (Abedon, Thomas-Abedon, et al., 2011; Golkar et al., 2014; Sulakvelidze et al., 2001).
No fue hasta 1915, cuando Frederick Twort (Twort, 1915), bacteriólogo inglés, estudiando el crecimiento del virus vacuna, encontró la existencia de un compuesto que podía atravesar un filtro Millipore, y además, destruir un cultivo bacteriano.
Twort propuso que este comportamiento tan singular ocurrido en los anteriores estudios podía haber ocurrido, entre varias opciones, debido a un virus (Golkar et al., 2014; Sulakvelidze et al., 2001; Watts, 2017; Wittebole et al., 2014).
No obstante, por diversas razones, Twort no pudo continuar con sus estudios (Golkar et al., 2014; Sulakvelidze et al., 2001). De esta manera, fue Félix d’Herelle (d’Herelle, 1917), microbiólogo franco-canadiense, quien, estudiando la shigelosis (una forma de disentería) de manera independiente de Twort, descubrió “oficialmente” los bacteriófagos en 1917 (Golkar et al., 2014; Lin et al., 2017; Sulakvelidze et al., 2001; Watts, 2017; Wittebole et al., 2014).
A decir verdad, él fue el científico que propuso el nombre de “bacteriófago” (Golkar et al., 2014; Lin et al., 2017).
Poco después de su descubrimiento, d’Herelle empezó a usar a los fagos para tratamientos terapéuticos, siendo 1919 el año del primer uso clínico documentado de fagos en un hospital, con resultado favorable (Keen, 2012; Lin et al., 2017; Sulakvelidze et al., 2001).
No obstante, el primer artículo en el que la terapia fágica fue documentada se publicó en 1921, siendo Bruynoghe y Maisin los autores de éste (Abedon, Kuhl, et al., 2011; Sulakvelidze et al., 2001; Wittebole et al., 2014).
Los primeros experimentos de d’Herelle eran controvertidos por tener un escaso control y su investigación era discutida, a pesar de que sus estudios tenían éxito (Lin et al., 2017). No obstante, esto no impidió que, tanto d’Herelle, como otros científicos, comprobaran el funcionamiento de los fagos en el uso terapéutico durante los siguientes años, como podemos comprobar en los artículos mencionados (Abedon, Kuhl, et al., 2011; Golkar et al., 2014; Keen, 2012; Lin et al., 2017; Sulakvelidze et al., 2001).

El éxito de los fagos al enfrentar a las bacterias llevó a la comercialización de fagos como productos farmacéuticos. Así, tanto d’Herelle como otros empresarios empezaron a comercializar fagos en países como Estados Unidos, Francia, Brasil y Georgia (Abedon, Kuhl, et al., 2011; Lin et al., 2017; Pirnay et al., 2012; Sulakvelidze et al., 2001).
De hecho, en Georgia, d’Herelle, junto a Giorgi Eliava, fundó el Instituto Eliava en 1923, e hizo gran parte de su trabajo allí (Sulakvelidze et al., 2001; Watts, 2017).
No obstante, la eficacia de los fagos era puesta en duda por la falta de estudios rigorosos sin errores, normalmente debida al escaso conocimiento acerca de la biología de los fagos (Keen, 2012; Lin et al., 2017; Sulakvelidze et al., 2001).
La Asociación Médica Americana (AMA) ordenó hacer revisiones acerca de la literatura fágica. Se hicieron tres revisiones, a saber, en los años 1934, 1941 y 1945. Estos trabajos mostraron los escritos sobre la terapia fágica como confusos y contradictorios; las preparaciones fágicas no tenían una composición clara, y mostraban además el antagonismo entre las pruebas in vitro positivas y las pruebas in vivo negativas (Summers, 2012).
Aun con todo, el factor más determinante para “enterrar” a la terapia fágica fue la aparición de los antibióticos y su probada eficacia en el control de enfermedades bacterianas durante la Segunda Guerra Mundial; este suceso llevó a que, tanto los antibióticos se convirtieran en la principal defensa terapéutica, como que la producción de fagos terapéuticos acabara casi por completo en Occidente a partir de los años cuarenta (Keen, 2012; Lin et al., 2017; Sulakvelidze et al., 2001; Summers, 2012).
En Occidente, la producción y el uso de fagos continuó a pequeña escala, con algunas compañías y centros produciendo preparaciones fágicas (Kutateladze and Adamia, 2010), siendo el caso más destacado el Instituto Pasteur de Francia, que produjo sobre 60 fagos terapéuticos en 1976 (Abedon, Kuhl, et al., 2011).
Este suceso también tuvo un trasfondo político: tras la finalización de la Segunda Guerra Mundial, las relaciones entre los Estados Unidos y la Unión Soviética se enfriaron, y todas las cosas “comunistas” eran sospechosas y mal vistas, lo que también incluía a la ciencia, y a la terapia fágica en este caso, ya que, con la creación del Instituto Eliava, la terapia fágica estaba más desarrollada dentro de la Unión Soviética (Summers, 2012).
De esta manera, en la antigua Unión Soviética y en Europa del Este la terapia fágica continuó siendo usada, y los fagos, siendo comercializados (Lin et al., 2017; Sulakvelidze et al., 2001).
El Instituto Eliava es uno de los centros que han tenido un papel importante en el desarrollo de la terapia fágica (Pirnay et al., 2012). Este organismo ha producido preparaciones de fagos para uso terapéutico, con capacidad de aplicación por diferentes rutas (oral, intravenosa, etc), sujetas a ensayos preclínicos y clínicos, a partir de los cuales se han publicado artículos reportando el funcionamiento de sus preparaciones (Kutateladze and Adamia, 2010).
Aun así, la carencia de regulación y estandarización internacional en los ensayos, y el hecho de que la gran mayoría de los escritos fueran en ruso y georgiano, provocó el rechazo de estos experimentos en Occidente, y la falta de confianza internacional hacia el uso de los fagos en terapia (Kutateladze and Adamia, 2010).
En Rusia, la terapia fágica es empleada de manera común en el ámbito clínico, y muchas empresas comercializan diferentes cócteles para diversas infecciones bacterianas (Brüssow, 2012). Sí, la historia de Rusia con la terapia fágica es extensa, pero las barreras lingüísticas provocan que ésta sea en gran parte inaccesible para quien no habla ruso (Abedon, Kuhl, et al., 2011).
Adicionalmente, la investigación fágica tuvo un uso primario militar, por lo que los estudios eran un secreto de estado, y las publicaciones se ocultaban (Abedon, Kuhl, et al., 2011). Y los pocos estudios publicados, al igual que Georgia, tenían problemas respecto a su caracterización, a saber, a la manera en la que hacían los ensayos y la posibilidad de repetirlos con unos mismos parámetros.
En palabras de Martha Clokie, catedrática de microbiología en la Universidad de Leicester, “la manera en la que los datos eran presentados tenían mucho de “estos son mis pacientes, esto es lo que les he dado, ha funcionado”, pero (en términos) de datos publicados desde ensayos controlados, muy poco” (Watts, 2017).
Pero estos problemas también ocurren hoy en día. Microgen, la farmacéutica más importante de Rusia, ofrece diversas preparaciones de fagos. No obstante, sus publicaciones acerca de las preparaciones o su eficacia clínica ocultan diversos datos que dificultan la comprobación del funcionamiento o no de sus productos (Abedon, Kuhl, et al., 2011; Brüssow, 2012).
Otro centro de gran relevancia en campo de la terapia fágica es el Instituto Hirszfeld de Polonia (Abedon, Kuhl, et al., 2011; Pirnay et al., 2012). Fundado en 1952, sus investigadores han escrito diversos artículos acerca de tratamientos en los que se han usado fagos específicos para cada paciente de la colección del Instituto, reportando un porcentaje de curados que variaba entre 75-100%, si bien gran parte de esos ensayos tenían en su haber determinados fallos, como el uso paralelo ocasional de antibióticos o la falta de estudios ciegos, lo que provoca dudas desde la medicina de Occidente (Abedon, Kuhl, et al., 2011).
Ahora bien, como Polonia ahora es país miembro de la Unión Europea, el uso de fagos en terapia antimicrobiana está regulado desde la perspectiva de Occidente, y su experiencia está sometida a diversas revisiones (Abedon, Kuhl, et al., 2011).
Como hemos visto, la terapia fágica nunca ha caído en el olvido del todo. Ahora bien, en Occidente este tratamiento no se redescubre hasta los años ochenta, cuando en la literatura inglesa se empiezan a publicar experimentos con animales (Wittebole et al., 2014), siendo la aparición de bacterias resistentes a los antibióticos el factor más importante para este renovado interés en la terapia fágica (Keen, 2012; Pirnay et al., 2012; Summers, 2012).
Ha habido un aumento exponencial de publicaciones relacionadas con la terapia fágica desde el inicio de este siglo, en el que además, ha comenzado el estudio en humanos (Pirnay et al., 2012; Wittebole et al., 2014)
De esta manera, el primer ensayo controlado aleatorizado en fase I para los fagos en los Estados Unidos fue publicado en 2009. En este ensayo, se evaluaba la seguridad de un cóctel de fagos frente a Escherichia coli, S. aureus y P. aeruginosa en pacientes con úlceras crónicas de pierna; no se detectó ningún efecto adverso (Wittebole et al., 2014).
Asimismo, en Londres, también en 2009, una compañía privada generó una serie de ensayos clínicos para estudiar la eficacia de un cóctel de fagos frente a P. aeruginosa en pacientes con otitis crónica; en éstos, se observaron una mejora de los síntomas, la no aparición de fagos en el organismo tras la eliminación de la bacteria objetivo, y además, no se reportaron efectos adversos (Kutateladze and Adamia, 2010; Wittebole et al., 2014).
Estos y otros estudios son una muestra de que los fagos y su potencial en terapia antimicrobiana están siendo analizados de nuevo; hoy en día, el debate continua (Summers, 2012).
La terapia fágica tiene un espectro estrecho de actuación, y su efecto se puede limitar a una especie, o incluso a una cepa dentro de una especie (Keen, 2012; Wittebole et al., 2014). Debido a esta característica, el impacto de los fagos sobre la flora bacteriana del cuerpo es mínimo, mientras que los antibióticos, por su espectro de acción, destruyen diversas bacterias con independencia de que sean o no patógenas (Kutateladze and Adamia, 2010; Loc-Carrillo and Abedon, 2011).
Además, esta característica repercute en la necesidad de la búsqueda precisa de la bacteria, y del fago (o fagos) específico para enfrentarla, lo que hace de la terapia fágica un tratamiento personalizado (Keen, 2012).
La especificidad también está estrechamente relacionada con la no aparición de efectos secundarios ni de infecciones secundarias, sucesos inversos a lo que ocurre con los antibióticos, especialmente los de amplio espectro, en los que se suelen reportar efectos secundarios severos (Golkar et al., 2014; Kutateladze and Adamia, 2010; Sulakvelidze et al., 2001).
A diferencia de los antibióticos, los fagos no son xenobióticos (molécula ajena a la estructura o el metabolismo biológico. Su caracterización puede presuponer el hecho de que sea producto de origen o creación humana. Puede ser lesivo), y la introducción y distribución de éstos dentro de diversas zonas del organismo es un proceso natural (Skurnik et al., 2007).
Además, mientras los antibióticos tienen una concentración en el cuerpo que decrece con el tiempo, el nivel de fagos va disminuyendo conforme ocurre la eliminación de la bacteria objetivo (Kutateladze and Adamia, 2010; Nobrega et al., 2015).
Los fagos pueden aumentar en número en función de la cifra de las bacterias objetivo, así que no es necesario usar la misma dosis equivalente a la de los antibióticos; en este caso, la dosis de fagos usados puede ser menor a la de antibióticos (Loc-Carrillo and Abedon, 2011).
Al depender de la bacteria la propagación de los fagos, ésta ocurre solo donde aparecen las bacterias, en el lugar de la infección, limitando así los fagos su actuación tanto en cantidad como en espacio. Por el contrario, los antibióticos no se concentran en el lugar de infección, sino que viajan por todo el cuerpo (Golkar et al., 2014; Nobrega et al., 2015).
Este es otro hecho por el cual se abre la posibilidad de generar tratamientos personalizados (Skurnik et al., 2007).
Los bacteriófagos consisten en proteínas y ácidos nucleicos, por lo que éstos son no-tóxicos, si bien hay que reconocer que existe la posibilidad de que dichos bacteriófagos puedan interactuar con el sistema inmune y desencadenar respuestas no deseadas (Loc-Carrillo and Abedon, 2011).
La liberación de compuestos de la bacteria al momento de la lisis es algo a tener en cuenta, aunque esto también ocurre con el uso de antibióticos (Loc-Carrillo and Abedon, 2011).
Ciertos fagos han demostrado ser eficaces en la limpieza de biofilms, mediante la hidrolización de los polisacáridos bacterianos que lo forman. Esta característica es especialmente útil para el tratamiento de bacterias formadoras de biofilm, como P. aeruginosa o S. aureus.
Estas formaciones las hacen más resistentes a los antibióticos, ya que dificulta, y hasta imposibilita a éstos su actuación, debido a que la matriz del biofilm es impermeable. (Abedon et al., 2017; Brunel and Guery, 2017; Loc-Carrillo and Abedon, 2011; Maciejewska et al., 2018).
Es verdad que las bacterias pueden adquirir resistencia hacia los fagos; de hecho, en el punto 5.1 aparecen diversos mecanismos por los que pueden desarrollar dicha resistencia. No obstante, como también se comentó en dicho punto, los fagos también desarrollan procesos para anular los mecanismos usados por las bacterias; así, aparecen mutaciones en éstos que vuelven a hacerlos útiles frente a estas bacterias (Keen, 2012).
De esta manera, el nivel de resistencia a los fagos es menor que a la de antibióticos, siendo la frecuencia de resistencia a fagos de entre 10-7 a 10-8 por célula, y la de los antibióticos cerca de 10-5 por célula (Kutateladze and Adamia, 2010).
También hay que decir que el uso combinado de fagos y antibióticos ayuda a retrasar el desarrollo de resistencia hacia los fagos: como la formación de resistencias se da mediante diversos mecanismos, el uso sinérgico de estas dos terapias debería dar resultados positivos, ya que es muy difícil que la bacteria tenga todas las mutaciones indicadas para enfrentar ambos tratamientos a la vez (Golkar et al., 2014; Keen, 2012; Kutateladze and Adamia, 2010).
Esta idea la desarrollaremos más adelante. En general, el uso clínico de los fagos extendería el tiempo de utilidad de los antibióticos, ya que no contribuye al aumento de la resistencia a éstos (Loc-Carrillo and Abedon, 2011).
Otro factor a tener en cuenta es, que el hecho de que los fagos sean agentes bactericidas es una circunstancia que disminuye el riesgo de resistencia, a diferencia de ciertos antibióticos, que al ser bacteriostáticos, facilitan el proceso de resistencia bacteriana (Loc-Carrillo and Abedon, 2011).
Las preparaciones de los fagos pueden ser adaptables; se pueden usar un único tipo de fago o varios, esta última es una preparación llamada cóctel, y son las preparaciones más usadas por su mayor espectro de acción antibacteriana.
Además, las formas de aplicación son diversas, con soluciones varias tales como cremas, líquidos, etc., así como las rutas de administración (Chan et al., 2013; Loc-Carrillo and Abedon, 2011; Nobrega et al., 2015). Podemos observar en la siguiente imagen la aplicación de terapia fágica mediante uso tópico.

Tanto la detección, como el aislamiento y la caracterización de los fagos son procesos rápidos y sus costes son relativamente bajos. También hay que tener en cuenta que, a medida que continúen las mejoras tecnológicas, el proceso de purificación de fagos irá reduciendo su precio (Loc-Carrillo and Abedon, 2011).
El proceso de desarrollo de los antibióticos, por el contrario, pueden tomar muchos años y requerir de mucho dinero para su comprobación clínica, por lo que podemos decir que el desarrollo de fagos tiene un coste menor al de los antibióticos (Golkar et al., 2014; Nobrega et al., 2015; Skurnik et al., 2007).
Un ejemplo de este menor precio se demostró en 6 pacientes que presentaban diversas infecciones provocadas por estafilococos entre las que aparecía S. aureus meticilin-resistente (Wittebole et al., 2014). Aunque el aumento del tipo de fagos en una preparación puede aumentar el precio de producción y manufacturado, el costo suele ser menor que en el caso de los antibióticos convencionales; aun así, es un inconveniente a revisar (Chan et al., 2013).
Si bien esta característica es la principal baza para ser una alternativa potencial a los antibióticos, este atributo también aumenta el riesgo de fallo en el tratamiento en el caso de que la bacteria objetivo del fago no sea la misma que la responsable de la infección; además, provoca la necesidad de determinar el microorganismo patógeno con total exactitud, y más tarde al bacteriófago adecuado para enfrentarlo, con el tiempo que esto conlleva (Brunel and Guery, 2017; Wittebole et al., 2014).
La solución a este espectro estrecho de actuación es el uso de cócteles de fagos, que cuenten con características complementarias, afectando cada fago a una cepa, o especie diferente; además, a medida que mejora la tecnología, la diagnosis bacteriana se hace de forma más rápida, siendo los métodos genómicos los más notables en este ámbito (Brunel and Guery, 2017; Nobrega et al., 2015; Wittebole et al., 2014)
Desde el principio de este tratamiento, ésta ha sido una de las principales razones por las que la eficacia de la terapia fágica ha sido tan controvertida. El principal incitador de la terapia fágica, Félix d’Herelle, efectuaba ensayos clínicos sin incluir grupos con placebo, tanto en humanos como animales.
Podemos encontrar errores similares en otros científicos en el comienzo de la terapia fágica, y por tanto, los resultados de éstos no generaban confianza (Sulakvelidze et al., 2001). Además, cuando ocurrió el auge de la terapia fágica en Europa de Este, no hubo una sistematización en el modo de desarrollo de los ensayos, y éstos no seguían las regulaciones de Occidente (Keen, 2012). Los hechos que acabamos de comentar daban lugar a reticencias sobre su eficacia.
No obstante, sí que podemos encontrar evidencias de la efectividad de la terapia fágica en ensayos con controles correctos, incluso en los ensayos desarrollados de Europa del Este. Aunque hay que reconocer que la mayoría no se hicieron con la regulación pertinente, sí que podemos encontrar documentación acerca del éxito del tratamiento de diversas infecciones con la terapia fágica en estudios regulados de manera correcta (Keen, 2012).
Varios ejemplos de este hecho aparecen en los artículos de Abedon y Sulakvelidze (Abedon, Kuhl, et al., 2011; Sulakvelidze et al., 2001). También podemos encontrar estudios actuales, desarrollados conforme a la regulación pertinente, en los que se demuestra la eficacia de la terapia fágica; estos estudios muestran que, efectivamente, la terapia fágica puede tener un futuro en la medicina de Occidente (Keen, 2012)
Las bacterias pueden desarrollar diversos mecanismos que las hacen resistentes a los fagos, y esto puede desembocar en una reducción de la eficacia de la terapia fágica (Wittebole et al., 2014). Los métodos a través de los cuales pueden adquirir resistencia aparecen en el punto 5.1.
Pero como ya hemos comentado anteriormente, las bacterias desarrollan una menor resistencia hacia los fagos. Además, respecto a esta resistencia hay que reportar que aparece especialmente en estudios in vitro, mientras que tiene una frecuencia baja in vivo (Wittebole et al., 2014).
Como ya hemos comentado anteriormente, los fagos lisogénicos (o temperados) pueden transferir genes de una bacteria a otra. Conjuntamente, los fagos lisogénicos cuentan con más inconvenientes, a saber: las bacterias infectadas por los fagos lisogénicos no mueren a causa de su infección, los fagos temperados suelen desarrollar una conversión lisogénica, en la que modifican el fenotipo de la bacteria, pudiendo aumentar su virulencia, así como el número de bacterias resistentes a antibióticos. Este hecho provoca que los fagos temperados no sean adecuados para la terapia fágica convencional (Nilsson, 2014).
Ahora bien, también hay que comentar que los fagos líticos también pueden desarrollar la transducción, y activar o aumentar los factores de virulencia de la bacteria, pero como matan a la bacteria en el caso de escoger el fago o cóctel correcto, se evitan estos problemas subyacentes (Abedon, Kuhl, et al., 2011).
El sistema inmune puede distinguir a los fagos como invasores, lo que puede provocar inactivación de los bacteriófagos (Maciejewska et al., 2018; Nobrega et al., 2015). De hecho, cualquier cambio, por mínimo que sea, en la composición de la cápside proteica vírica puede afectar a su inmunogenicidad y al tiempo de circulación en la sangre (Maciejewska et al., 2018).
Si los fagos son percibidos como elementos extraños, serán rápidamente excluidos del sistema circulatorio, haciendo que la concentración de fagos para el tratamiento no sea la adecuada (Nobrega et al., 2015; Wittebole et al., 2014).
Asimismo, durante la lisis de la bacteria mediada por los fagos, la bacteria puede liberar diversas sustancias tales como endotoxinas, que pueden causar diversos efectos secundarios o agravar síntomas. Ahora bien, tenemos que decir que ocurre algo parecido con los antibióticos (Nilsson, 2014; Wittebole et al., 2014).
Aunque estas posibles reacciones dependen del lugar de la infección, también dependen de la manera en la que los fagos han sido aplicados; así, la aplicación tópica no muestra efectos secundarios, pero sí que aparecen complicaciones en la aplicación intravenosa (Nilsson, 2014).
A diferencia de otras partes de nuestro cuerpo, la sangre no es un ambiente natural para los fagos, y la presencia de éstos activa los sistemas inmunes adaptativo e innato; aparecen la actividad fagocítica, aumento de inmunoglobulinas IgM e IgG y, en resumen, diversas respuestas inmunes a la inyección de los fagos (Nilsson, 2014).
Aunque no han aparecido reacciones inmunológicas serias en los ensayos clínicos y con animales, el potencial riesgo de una reacción hace que sea necesario el testeo de la respuesta inmunológica de cada fago, especialmente en el caso de la aplicación intravenosa (Nilsson, 2014).
La activación del sistema inmune mediante proteínas fágicas puede tener propiedades inmunomoduladoras. Como ya hemos comentado, los fagos pueden afectar a la actividad fagocítica y a una posible respuesta inflamatoria (Maciejewska et al., 2018).
Ahora bien, la preparación del fago (especie, dosis, pureza y ruta de administración) es el factor que determina la respuesta final, pudiendo intensificar, o incluso inhibir, estos procesos (Maciejewska et al., 2018).
La terapia fágica tiene una farmacocinética compleja debido a varios factores: el tamaño de los fagos, ya que éstos tienen un gran tamaño en comparación a los antibióticos moleculares, y limitan la concentración de éstos en una dosis; el número de fagos necesario para infectar a la bacteria, puesto que la eficacia de la terapia fágica radica en este aspecto, y la variación de la virulencia del propio fago (Nilsson, 2014).
Otros factores a tener en cuenta son la composición de la cápside proteica fágica y la aparición de anticuerpos específicos para fagos, con capacidad de inactivar y eliminar a éstos (Maciejewska et al., 2018).
Teniendo en cuenta estos aspectos, la mejor solución parece ser el uso de fagos más virulentos, es decir, fagos que liberen un mayor número de viriones al momento de la lisis bacteriana. De esta manera, se podría compensar la dosis baja inicial (Nilsson, 2014).
El uso de cócteles fágicos aumenta el espectro de acción y, bien preparado, puede desarrollar efectos sinérgicos, reduciendo la aparición de resistencias (Nilsson, 2014), y previniendo la reactividad de los anticuerpos de fagos (Maciejewska et al., 2018).
A diferencia de otros sectores, como la industria alimentaria o la biología molecular, la industria farmacéutica no parece haber mostrado especial interés en los fagos; no se sabe bien si ya han llegado a la conclusión de que los fagos no son rentables tras estudiar la situación, si no quieren que la terapia fágica compita con los antibióticos o no tienen el conocimiento necesario para este campo. Sea la razón que fuere, las farmacéuticas no consideran a los fagos como comercializables (Brüssow, 2012).
En el campo de la biología molecular, los bacteriófagos han sido usados como modelos de estudio de los mecanismos virales y para hallar formas de modificar las células, por lo que la falta de conocimiento acerca de los fagos no parece ser el impedimento para su uso clínico. Hay que centrarse en otros motivos, y los más claros parecen ser el financiero y la manera de regulación de los fagos (Watts, 2017).
Hay que comentar que, observando la terapia fágica desde una perspectiva comercial, es difícil registrar las preparaciones fágicas como patentes u obtener sus derechos de propiedad. Según la ley de patentes, un invento es considerado como tal, si nunca ha formado parte de la tecnología disponible hasta el momento, así que para que un fago o un cóctel de fagos se puedan declarar como una patente, éstos nunca deben haber sido aislados o producidos antes.
En Europa se pueden patentar fagos naturales para uso médico, siempre y cuando se demuestre que su uso es nuevo, así que, los fagos aislados deben estar caracterizados de manera apropiada. No obstante, la “parte técnica” de la patente de un fago es conocida desde los años veinte, por lo que la caracterización del fago no parece ser difícil de hallar.
El desarrollo y producción de un medicamento requiere de millones de euros; con una protección de la propiedad intelectual tan esquiva, se hace difícil apostar por la terapia fágica a una empresa (Pirnay et al., 2012).
Tanto en Estados Unidos como en la Unión Europea, los productos fágicos están sujetos a la misma regulación que las medicinas convencionales (Maciejewska et al., 2018; Pirnay et al., 2012).
La normativa actual limita el uso de la terapia fágica a una forma individual, un solo paciente, lo que provoca que las compañías farmacéuticas pierdan el interés en desarrollar preparaciones de fagos (Maciejewska et al., 2018).
Con esta regulación, se pierde la mayor ventaja de la terapia fágica, y es la capacidad de evolución de los fagos. Los fagos pueden cambiar en cuestión de semanas o incluso días, y así enfrentan de manera directa las resistencias bacterianas (Pirnay et al., 2012).
Además, se pueden crear fagos mejorados genéticamente; siendo ésta otra característica no permitida según la regulación vigente (Maciejewska et al., 2018).
Según la normativa actual, cada tipo de fago es considerado una nueva droga. Teniendo en cuenta que en la terapia fágica es necesario un conjunto de fagos, parece difícil que esta terapia llegue a tener éxito si esta normativa sigue vigente de esta manera en el futuro (Watts, 2017).
Ahora bien, mientras que la creación de un medicamento tradicional requiere de años de desarrollo, la formación de un fago viable ocurre en semanas o días, lo que demuestra que el desarrollo de la terapia fágica requiere de una normativa más flexible (Pirnay et al., 2012).
No obstante, hay que decir que los organismos gubernamentales parecen tener interés en facilitar el desarrollo de la terapia fágica. Así, en 2015 hubo una reunión en la EMA en la que se revisaron los aspectos regulatorios y de la calidad de la terapia fágica, así como hechos a tener en cuenta en el desarrollo clínico. Se pueden observar las conclusiones de dicha reunión en el artículo de Pelfrene (Pelfrene et al., 2016).
Otro factor a tener en cuenta es la opinión del público general. Los fagos, como son virus, pueden ser confundidos con otros tipos de virus más conocidos, los patógenos virales que causan enfermedades. No obstante, hay que decir que, por el momento, esto no está ocurriendo, aunque hay que tener en cuenta que la terapia con fagos no es especialmente conocida para el público (Loc-Carrillo and Abedon, 2011).
Dentro de la terapia fágica, podemos distinguir entre la terapia fágica convencional, la terapia con enzimas fágicas y la terapia combinada de bacteriófagos y antibióticos (Brunel and Guery, 2017). Dentro de la terapia combinada de bacteriófagos y antibióticos, aparece el uso de fagos como adyuvantes de los antibióticos (Lu and Collins, 2009).
Conjuntamente a éstas, el uso de fagos como vacunas también aparece como una opción a tener en cuenta (Adhya et al., 2014). Todas estas aplicaciones representan el presente y futuro de la terapia fágica.
La terapia fágica clínica es el tratamiento o prevención de infecciones en humanos y el uso de bacteriófagos en la modificación del microbioma (Abedon et al., 2017). En la terapia fágica convencional, aparecen dos formas de enfrentar a la bacteria:
Un fago. El uso de un único fago aumenta el riesgo de generar bacterias resistentes a dicho bacteriófago. Este hecho, unido al limitado espectro de acción que ofrece un único fago desecha esta opción para terapia clínica (Malik et al., 2017). La opción usada en la terapia fágica convencional es el cóctel de fagos.
Cóctel de fagos. Para la terapia fágica, los fagos líticos se compilan en preparaciones de múltiples fagos llamadas cóctel, cuya eficacia ya ha sido probada in vitro frente a la bacteria objetivo anteriormente (Lin et al., 2017).
También hay que tener en cuenta, como ya hemos comentado en el punto 5.3, que la terapia fágica convencional solo puede ser llevada a cabo por fagos líticos, no temperados, ya que solo en los fagos líticos tenemos la seguridad de que éstos tengan efecto bactericida (Maciejewska et al., 2018).
De forma simultánea al renovado interés en la terapia fágica convencional, ha habido grandes esfuerzos en desarrollar agentes antibacterianos a partir de proteínas decodificadas por fagos (Roach and Donovan, 2015). Aquí están los ejemplos más notables.
Endolisinas. Estas enzimas se encargan de degradar la pared celular bacteriana de peptidoglicano durante la fase tardía de la replicación en los fagos. Esta degradación provoca inestabilidad de la pared bacteriana, que termina desembocando en la ruptura de ésta por las diferencias de la presión osmótica entre el interior y el exterior celular.
Estas enzimas aparecen especialmente en fagos que se enfrentan a bacterias grampositivas, ya que en bacterias gramnegativas tiene como barrera extra a la membrana externa (Roach and Donovan, 2015).
Peptidoglicano hidrolasas asociadas al virión. Esta enzima participa en la hidrólisis de la pared celular de peptidoglicano después del acoplamiento del fago. No provoca la lisis de la bacteria, más bien degrada el peptidoglicano a nivel local para que el fago pueda transferir su ADN, facilitando su labor.
De esta manera, la rotura de la capa de proteoglicano desemboca en lisis osmótica y muerte de la bacteria. Estas enzimas aparecen en fagos que atacan a bacterias tanto grampositivas o gramnegativas (Latka et al., 2017; Roach and Donovan, 2015).
Polisacárido depolimerasas. Estas hidrolasas degradan carbohidratos macromoleculares dentro de los polisacáridos extracelulares y los lipopolisacáridos que envuelven la pared celular bacteriana (Roach and Donovan, 2015).
No tienen actividad antibacteriana, pero poseen el potencial de reducir la virulencia de las bacterias, ya que estas proteínas provocan la pérdida o la modificación de estructuras que aparecen en el exterior de la bacteria. Esta propiedad hace que estas enzimas deban ser tenidas en cuenta para la terapia clínica (Latka et al., 2017).
Una de esas estructuras es el biofilm bacteriano; las depolimerasas tienen la capacidad de degradarlo. De hecho, hay varios estudios confirmando este fenómeno; éstos se pueden observar en el trabajo de Maciejewska (Maciejewska et al., 2018).
Holinas. Estas proteínas están relacionadas con la fase de lisis bacteriana; son responsables de una mayor permeabilización de la membrana celular, que permite a las endolisinas atacar al peptidoglicano. De este hecho podemos deducir que, el uso combinado de holinas y endolisinas puede aumentar la potencia lítica del tratamiento (Roach and Donovan, 2015).
El tratamiento con enzimas fágicas tiene similitudes y diferencias al compararlo con la terapia fágica convencional. La diferencia más destacable es que el espectro de acción de las enzimas fágicas es variable.
Así, las lisinas producidas por bacteriófagos específicos de bacterias grampositivas son muy específicas, pudiendo llegar a nivel de especie, o incluso a nivel de serotipo. Por el contrario, las lisinas producidas por bacteriófagos de bacterias gramnegativas tienen un espectro de acción más amplio, pudiendo actuar frente a un rango de especies (Maciejewska et al., 2018).
El uso combinado de ambos agentes ha obtenido excelentes resultados in vivo e in vitro, tanto en lo respectivo a la eliminación de la bacteria objetivo, como en la limitación de resistencias (Torres-Barceló and Hochberg, 2016). Así, se observa un efecto de sinergia en el uso combinado de estos compuestos especialmente en infecciones provocadas por bacterias formadoras de biofilms (Maciejewska et al., 2018).
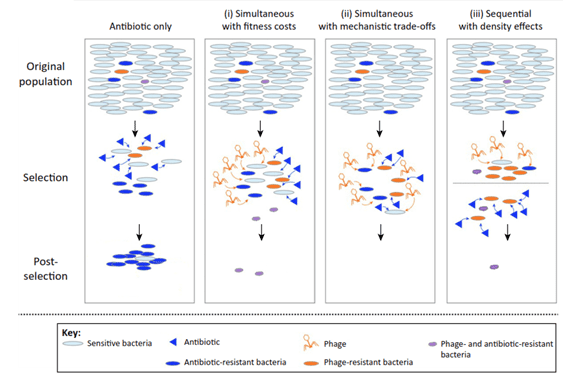
Normalmente, la bacteria resistente a uno de los agentes es eliminada por el otro medicamento; sin embargo, pueden darse más casos; en la imagen siguiente podemos verlos esquematizados. El uso simultáneo de estos dos agentes puede generar la aparición de bacterias resistentes a ambos agentes; este hecho tiene unos costes de adaptación, por lo que estos “dobles resistentes” crecen de forma lenta y son menos patogénicos que las bacterias sensibles.
Otro posible efecto del uso simultáneo de fagos y antibióticos es la restricción de la posible evolución de la bacteria, de forma que ésta puede desarrollar resistencia al fago, pero hacerla sensible al antibiótico, o viceversa.
El uso secuencial de estos agentes reduce la probabilidad de mutaciones de resistencia en pequeñas poblaciones, y el crecimiento de poblaciones con dichas mutaciones es limitado (Torres-Barceló and Hochberg, 2016).
Esta forma de terapia puede atraer el interés de las empresas farmacéuticas, ya que pueden esquivar diversos problemas en lo referente a la regulación. No obstante, en la actualidad no se entiende del todo el fenómeno de sinergia y los mecanismos subyacentes de éste, por lo que hace falta una mejor comprensión del tema para una aplicación más precisa de esta terapia (Torres-Barceló and Hochberg, 2016).
Como hemos visto anteriormente, aunque no sirven para la terapia fágica convencional, los fagos lisogénicos pueden tener determinados usos en terapia. El proceso de transducción puede ser usado para transferir genes entre el fago y la bacteria, de forma que ésta se vuelva más sensible a los antibióticos (Wittebole et al., 2014).
Un estudio llevado a cabo por microbiólogos de la Universidad de Tel Aviv así lo demostró. Su experimento se llevó a cabo con dos cepas de E. coli, una con resistencia a la estreptomicina, y otra con resistencia al ácido nalidíxico.
Mediante este proceso de lisogenización, los fagos transferían una serie de cassettes génicos que aportan sensibilidad al antibiótico a una serie de genes determinados, rpsL y gyrA, respectivamente. Los resultados fueron favorables, y si bien esta recombinación genética no es útil para matar a la bacteria, sí que la hace más sensible al patógeno a los antibióticos a los que previamente era resistente.
Esta característica es de gran utilidad, especialmente en los hospitales, lugares donde aparecen microbios resistentes con facilidad (Edgar et al., 2011).
Otro experimento llevado a cabo por la Universidad de Boston tuvo resultados similares. En éste, usaron una combinación de antibióticos y fagos modificados genéticamente para acabar con una cepa de E. coli.
Este fago tenía el objetivo de sobreexpresar el gen lexA3, un represor de la respuesta SOS. El modo de funcionamiento de este experimento se puede observar en la imagen 6. Los antibióticos dañan el ADN, provocando la inducción de la respuesta SOS.
El fago suprime la respuesta SOS, actuando como adyuvante del antibiótico, y, de esta manera, aumenta el número de bacterias muertas. Los resultados fueron favorables: se observó un aumento de la supervivencia de ratones infectados, así como una reducción de la aparición de bacterias resistentes a antibióticos (Lu and Collins, 2009).

Sin embargo, hay que decir que el uso de fagos modificados genéticamente esta prohibido por los organismos gubernamentales de Estados Unidos y Europa (Maciejewska et al., 2018).
Una idea que está siendo evaluada es el uso de fagos como agentes presentadores del antígeno en las vacunas, ya que éstos tienen la capacidad de estimular el sistema inmune, tanto el humoral como el celular.
En la actualidad, aparecen dos formas por las que los bacteriófagos pueden ser usados en la vacunación: en una, se producen partículas inmunogénicas que muestran al antígeno en la superficie fágica (phage display vaccines); mientras que, en la otra, las vacunas de fagos de ADN se producen por la incorporación de genes del antígeno al genoma fágico bajo el control de promotores eucariotas fuertes.
Así, los fagos se usan como portadores pasivos para transferir ADN que codifica el antígeno en células de mamíferos donde el gen del antígeno es expresado (phage DNA vaccines) (Adhya et al., 2014).
Normalmente, estos dos métodos se suelen combinar, de manera que se producen fagos que portan el gen del antígeno a la vez que muestra proteínas o péptidos de éste en su superficie. Las proteínas de la superficie son seleccionadas en función de su afinidad con las células presentadoras de antígeno (Adhya et al., 2014).
Las partículas fágicas son estables de forma natural, por lo que su procesado es sencillo, y ofrece la posibilidad de generar producción de vacunas a larga escala a un precio menor que el actual. A esto hay que sumarle que funciona como adyuvante, mejorando la respuesta inmune frente al antígeno que presenta. (Adhya et al., 2014).
Abedon ST, Thomas-Abedon C, Thomas A, et al. (2011) Bacteriophage prehistory. Bacteriophage 1(3):
174–178. DOI: 10.4161/bact.1.3.16591.
Abedon ST, Kuhl SJ, Blasdel BG, et al. (2011) Phage treatment of human infections. Bacteriophage
1(2): 66–85. DOI: 10.4161/bact.1.2.15845.
Abedon ST, García P, Mullany P, et al. (2017) Editorial: Phage Therapy: Past, Present and Future. Frontiers
in Microbiology 8. DOI: 10.3389/fmicb.2017.00981.
Adhya S, Merril CR and Biswas B (2014) Therapeutic and Prophylactic Applications of Bacteriophage
Components in Modern Medicine. Cold Spring Harbor Perspectives in Medicine 4(1): a012518. DOI: 10.1101/cshperspect.a012518.
Brunel A-S and Guery B (2017) Multidrug resistant (or antimicrobial-resistant) pathogens - alternatives
to new antibiotics? Swiss Medical Weekly 147: w14553. DOI: 10.4414/smw.2017.14553.
Brüssow H (2012) What is needed for phage therapy to become a reality in Western medicine? Virology
434(2). Special issue: viruses of microbes: 138–142. DOI: 10.1016/j.virol.2012.09.015.
Chan BK, Abedon ST and Loc-Carrillo C (2013) Phage cocktails and the future of phage therapy. Future
Microbiology 8(6): 769–783. DOI: 10.2217/fmb.13.47.
d’Herelle F (1917) Sur un microbe invisible antagoniste des bacilles dysentériques. CR Acad. Sci. Paris 165: 373–375.
Edgar R, Friedman N, Molshanski-Mor S, et al. (2011) Reversing Bacterial Resistance to Antibiotics
by Phage-Mediated Delivery of Dominant Sensitive Genes. Applied and Environmental Microbiology: AEM.05741-11. DOI: 10.1128/AEM.05741-11.
Eliava Institute (n.d.). Available at: https://eptc.ge/about-eptc/ (página visitada por última vez
el 12 de abril de 2021).
Gamaleya NF (1898) Bacteriolysins—ferments destroying bacteria. Russ. Arch. Pathol. Clin. Med.
Bacteriol 6: 607–613.
Golkar Z, Bagasra O and Pace DG (2014) Bacteriophage therapy: a potential solution for the antibiotic
resistance crisis. The Journal of Infection in Developing Countries 8(02): 129–136. DOI: 10.3855/jidc.3573.
Górski A, Międzybrodzki R, Weber-Dąbrowska B, et al. (2016) Phage Therapy: Combating Infections with
Potential for Evolving from Merely a Treatment for Complications to Targeting Diseases. Frontiers in Microbiology 7. DOI: 10.3389/fmicb.2016.01515.
Hankin E (1896) The bactericidal action of the waters of the Jumna and the Ganges on Vibrio
cholerae. Ann Inst Pasteur 10: 511.
Josep Mensa Pueyo, José María Gatell Artigas, Jose Elías García Sánchez (2018) Guía de Terapéutica antimicrobiana. 28th ed. Barcelona (España): Ediciones Escofet Zamora, S. L.
Keen EC (2012) Phage Therapy: Concept to Cure. Frontiers in Microbiology 3. DOI: 10.3389/fmicb.2012.00238.
Kutateladze M and Adamia R (2010) Bacteriophages as potential new therapeutics to replace or supplement antibiotics. Trends in Biotechnology 28(12): 591–595. DOI: 10.1016/j.tibtech.2010.08.001.
Labrie SJ, Samson JE and Moineau S (2010) Bacteriophage resistance mechanisms. Nature Reviews
Microbiology 8(5): 317–327. DOI: 10.1038/nrmicro2315.
Latka A, Maciejewska B, Majkowska-Skrobek G, et al. (2017) Bacteriophage-encoded virion-associated
enzymes to overcome the carbohydrate barriers during the infection process. Applied Microbiology and Biotechnology 101(8): 3103–3119. DOI: 10.1007/s00253-017-8224-6.
Lin DM, Koskella B and Lin HC (2017) Phage therapy: An alternative to antibiotics in the age of multi-drug
resistance. World Journal of Gastrointestinal Pharmacology and Therapeutics 8(3): 162–173. DOI: 10.4292/wjgpt.v8.i3.162.
Loc-Carrillo C and Abedon ST (2011) Pros and cons of phage therapy. Bacteriophage 1(2): 111–114.
DOI: 10.4161/bact.1.2.14590.
Lu TK and Collins JJ (2009) Engineered bacteriophage targeting gene networks as adjuvants for antibiotic
therapy. Proceedings of the National Academy of Sciences of the United States of America 106(12): 4629–4634. DOI: 10.1073/pnas.0800442106.
Lu TK and Koeris MS (2011) The next generation of bacteriophage therapy. Current Opinion in
Microbiology 14(5). Antimicrobials/Genomics: 524–531. DOI: 10.1016/j.mib.2011.07.028.
Maciejewska B, Olszak T and Drulis-Kawa Z (2018) Applications of bacteriophages versus phage enzymes to combat and cure bacterial infections: an ambitious and also a realistic application? Applied Microbiology and Biotechnology 102(6): 2563–2581. DOI: 10.1007/s00253-018-8811-1.
Malik DJ, Sokolov IJ, Vinner GK, et al. (2017) Formulation, stabilisation and encapsulation of bacteriophage for phage therapy. Advances in Colloid and Interface Science 249. Recent nanotechnology and colloid science development for biomedical applications: 100–133. DOI: 10.1016/j.cis.2017.05.014.
Nilsson AS (2014) Phage therapy—constraints and possibilities. Upsala Journal of Medical Sciences
119(2): 192–198. DOI: 10.3109/03009734.2014.902878.
Nobrega FL, Costa AR, Kluskens LD, et al. (2015) Revisiting phage therapy: new applications for old
resources. Trends in Microbiology 23(4): 185–191. DOI: 10.1016/j.tim.2015.01.006.
Pelfrene E, Willebrand E, Cavaleiro Sanches A, et al. (2016) Bacteriophage therapy: a regulatory
perspective. Journal of Antimicrobial Chemotherapy 71(8): 2071–2074. DOI: 10.1093/jac/dkw083.
Pirnay J-P, Verbeken G, Rose T, et al. (2012) Introducing yesterday’s phage therapy in today’s
medicine. Future Virology 7(4): 379–390. DOI: 10.2217/fvl.12.24.
Reindel R and Fiore CR (2017) Phage Therapy: Considerations and Challenges for Development. Clinical
Infectious Diseases 64(11): 1589–1590. DOI: 10.1093/cid/cix188.
Roach DR and Donovan DM (2015) Antimicrobial bacteriophage-derived proteins and therapeutic
applications. Bacteriophage 5(3): e1062590. DOI: 10.1080/21597081.2015.1062590.
Skurnik M, Pajunen M and Kiljunen S (2007) Biotechnological challenges of phage therapy. Biotechnology
Letters 29(7): 995–1003. DOI: 10.1007/s10529-007-9346-1.
Sulakvelidze A, Alavidze Z and Morris JG (2001) Bacteriophage Therapy. Antimicrobial Agents and
Chemotherapy 45(3): 649–659. DOI: 10.1128/AAC.45.3.649-659.2001.
Summers WC (2012) The strange history of phage therapy. Bacteriophage 2(2): 130–133. DOI: 10.4161/bact.20757.
Torres-Barceló C and Hochberg ME (2016) Evolutionary Rationale for Phages as Complements of
Antibiotics. Trends in Microbiology 24(4): 249–256. DOI: 10.1016/j.tim.2015.12.011.
Twort FW (1915) An investigation on the nature of ultra-microscopic viruses. The Lancet
186(4814): 1241–1243.
Watts G (2017) Phage therapy: revival of the bygone antimicrobial. The Lancet 390(10112):
2539–2540. DOI: 10.1016/S0140-6736(17)33249-X.
Weinbauer MG (2004) Ecology of prokaryotic viruses. FEMS Microbiology Reviews 28(2): 127–181. DOI:
10.1016/j.femsre.2003.08.001.
Wittebole X, De Roock S and Opal SM (2014) A historical overview of bacteriophage therapy as an alternative to antibiotics for the treatment of bacterial pathogens. Virulence 5(1): 226–235. DOI: 10.4161/viru.25991.